Intercambio Iónico para la eliminación de Contaminantes Metálicos
Por: Pedraza Fonseca, Daniel Sebastián 1, Martínez Barrón Juan Carlos 2, Salazar Hernández, Ma. Mercedes2, Alvarado Montalvo, Lucía Guadalupe2*
Resumen
La remoción de metales pesados del agua residual proveniente de la industria y minería es de vital importancia, por tal razón en este trabajo se llevó a cabo la evaluación de dos resinas combinadas IRA-900 y Dowex Mac-3 para la remoción de Cr (III) y Cr (VI) en sistemas tipo Batch realizando pruebas de dosificación, donde se encontró que las masas adecuadas para la remoción: 2g para Cr (III) y 0.5 g para Cr (VI). Las isotermas de Langmuir y Freundlich como modelos asociados mostraron capacidades máximas (q max) de 14.903 mg de Cr(III) gresina -1 y 149.253 mg Cr (VI) gresina -1 y valores de KL de 0.836 y 2.93*10-4 (L/g) respectivamente que muestran isotermas favorables, en cuanto a la isoterma de Freundlich se obtuvieron valores de n > 1 y entre 2 y 10 para Cr (III) y Cr (VI) esto se relaciona con una interacción adsorbente-adsorbato física e intensidad de adsorción favorable; finalmente las pruebas de cinética mostraron tiempos de remoción aceptables para Cr (III) cercanos a los 30 min y para Cr (VI) 90 min siendo IRA- 900 candidata para procesos continuos.
Palabras Clave: Intercambio iónico; Cromo trivalente; Cromo hexavalente; Isotermas Adsorción
Abstract
The removal of heavy metals from the wastewater from industry and mining is of vital importance. In this work, the evaluation of Dowex Mac-3 and IRA-900 combined resins for the removal of Cr (III) And Cr (VI) in Batch-type systems, where dosage tests were found to be suitable for removal of Cr (III) and Cr (III). The Langmuir and Freundlich isotherms as associated models showed maximum capacities (q max) of 14,903 mg Cr (III) gresin -1 and 149,253 mg Cr (VI) gresin -1 and KL values of 0.836 and 2.93 * 10-4 ( L / g), respectively, which show favorable isotherms for the Freundlich isotherm, obtained values of n > 1 and between 2 and 10 for Cr (III) and Cr (VI), this is related to an adsorbent-physical adsorbate interaction and intensity of favorable adsorption finally the kinetic tests showed acceptable removal times for Cr (III) near 30 min and for Cr (VI) 90 min, being IRA-900 candidate for continuous processes.
Introducción
El cromo es un elemento significativo del ambiente encontrado en rocas, animales, plantas, suelo, desechos y gases de volcán, así como parte de procesos industriales, tales como la galvanoplastia, fabricación de pigmentos y cementos. Los principales estados de oxidación del cromo son (III) y (VI). Sin embargo, mientras que el Cr (III) es un elemento traza esencial en el metabolismo de la glucosa, el cromo hexavalente es un oxidante fuerte y tóxico para humanos y animales. Así, en comparación con el cromo hexavalente el estado trivalente es mucho menos activo debido a su mala absorción [1], siendo, en general, el estado hexavalente considerado como un poderoso agente carcinogénico que modifica la transcripción de ADN causando importantes aberraciones cromosómicas [2]. Por tal razón han sido diseñadas técnicas de separación para eliminar Cromo de aguas residuales, por ejemplo: precipitación, filtración por membrana, adsorción e intercambio iónico, entre otras [3].
En materia de adsorción, se han investigado algunos adsorbentes de bajo costo para el tratamiento de soluciones que contengan Cr (VI), como lo han sido los residuos del proceso cervecero, residuos de la uva, aserrín, cáscara de fruta, entre otros [4,5], utilizándolos en regiones donde su disponibilidad local implica un bajo costo y requerimiento mínimos de pretratamiento, encontrándose una capacidad de adsorción relativamente baja: < 50 mg Cr (VI)/gresina [6,7].
En la presente investigación se abordó el uso de resinas poliméricas como intercambiadores iónicos, para remover especies de cromo trivalente y hexavalente, ya que son sus estados acuosos más comunes, utilizando resinas comerciales en un sistema tipo batch: IRA-900 y Dowex Mac-3.
Materiales y métodos
Las soluciones fueron preparadas a partir de K2Cr2O7 y CrCl3 grado reactivo, de los cuales se procedió a la preparación de soluciones madre de 1000 ppm de Cr (III) y Cr (VI) respectivamente, para la posterior preparación de las soluciones de cada experimento por dilución de la misma. El agua utilizada fue destilada y todos los experimentos se llevaron a cabo a temperatura ambiente de 20 oC. Los análisis de concentración fueron realizados por Absorción Atómica con un equipo Perkin Elmer.
Acondicionamiento
Las resinas utilizadas fueron: IRA-900MR (aniónica) Rhom&Haas y Dowex Mac-3MR (catiónica) Dow Chemical Company. La primer resina fue acondicionada manteniéndola en agitación durante 30 min con KOH 0,1 N y la segunda con HCl 0,1 N, seguido de dos lavados en agua destilada, cada uno de 15 minutos y un posterior secado a 100 oC.
Dosificación
En esta prueba se evaluó la masa de resina a utilizar. Se prepararon soluciones de 100 mg/L de Cr (VI) y Cr (III) respectivamente, se midieron 100 mL de la solución y se pusieron en contacto con diferentes cantidades de la resina catiónica y aniónica, en una relación 1:1: 0.05, 0.1, 0.5, 1, 1.5, 2.0 y 2.5 g. Cada sistema se sometió en agitación durante 2 h, después del cual se filtró y se analizó la solución, evaluando la concentración de Cr total.
Isotermas
Para determinar la capacidad de intercambio de las resinas, se evaluaron los puntos de los distintos equilibrios del experimento de dosificación y se procedió a aplicar los modelos de isotermas de Langmuir y Freundlich.
Cinética
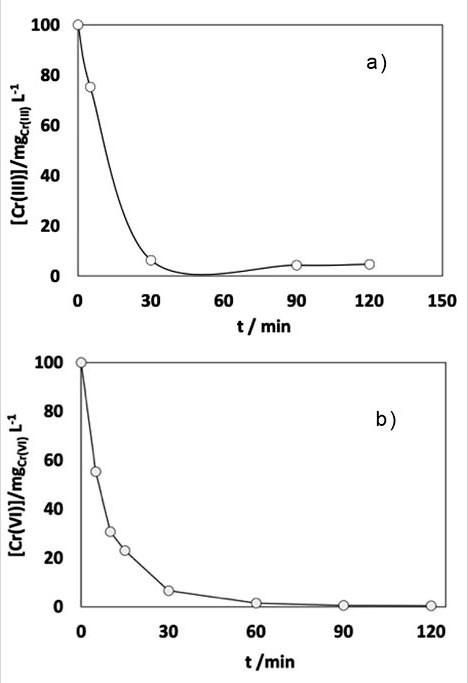
Utilizando una solución inicial de 100 mg/L y con las masas de 0.5 g para Cr (VI) y 2 g para Cr (III) de resina en relación 1:1, se evaluaron las concentraciones finales, al mantener el sistema en agitación durante distintos tiempos de contacto.
Resultados y discusión
Dosificación
Como se puede observar en la imágen 1a para Cr (III) y 1b para Cr (VI), la concentración del cromo en la solución disminuye al aumentar la cantidad de masa de resina; verificándose que para Cr (III), imagen 1a, desde el uso de 0.5 g de resina se ha removido alrededor del 50% de la concentración de cromo, decayendo de manera más significativa al utilizar 1.5 g de intercambiador y estabilizándose a partir de 2 g, donde el valor de la concentración es prácticamente cero.
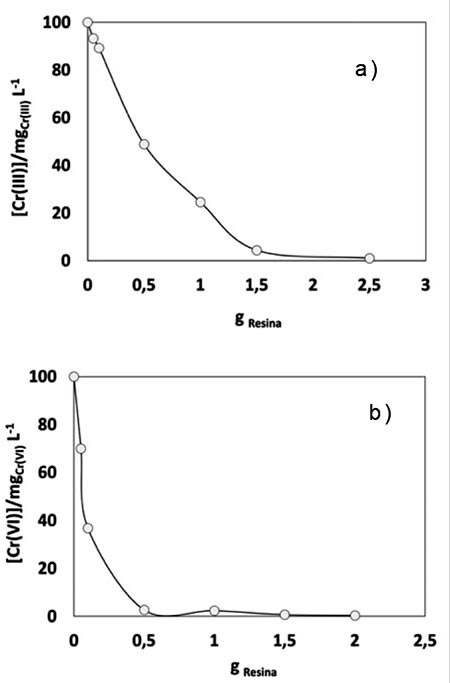
Imagen 1: Prueba dosificación, [Cr] respecto a masa de intercambiador iónico, a) Cr (III), b) Cr (VI).
Para el caso de Cr (VI), imagen 1b, la concentración decae a menos de 40 mg/L con el uso de 0.1 g de resina, alcanzando una remoción prácticamente total de cromo con 0.5 g de resina.
Isotermas
Para determinar la capacidad máxima de intercambio iónico de la resina se estudiaron los modelos de isotermas de adsorción de Langmuir y Freundlich; en la imagen 2 se presenta el equilibrio entre las concentraciones de Cr (III) en la fase líquida y sólida, respectivamente. Como puede ser observado, la concentración en ambas fases va en aumento, alcanzando un equilibrio al llegar a la concentración de la fase sólida de 14.9 mg de Cr (III) por gramo de resina.
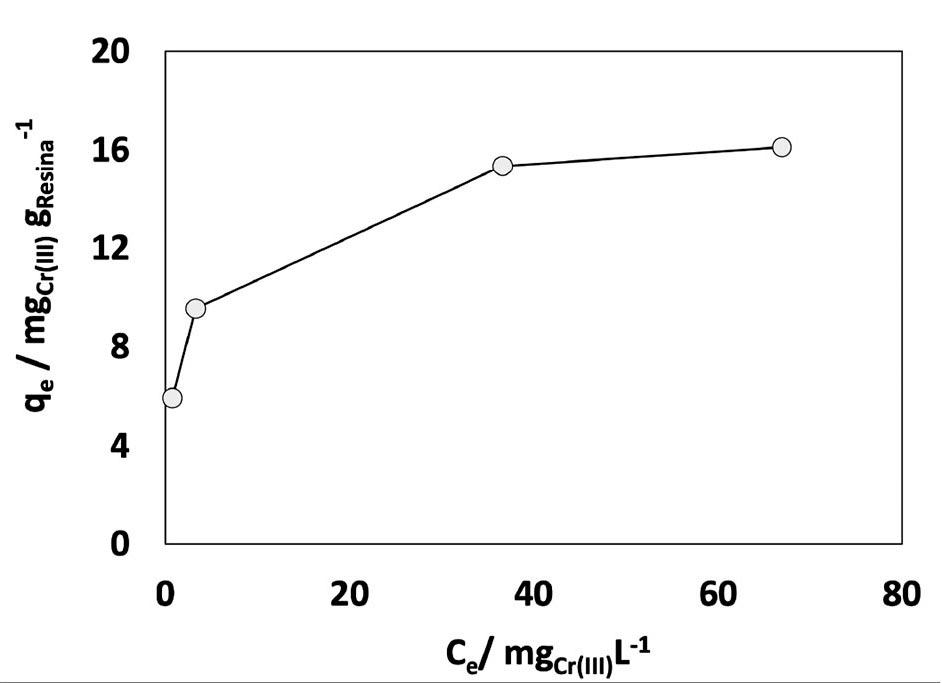
En la imagen 3 se presentan los ajustes a los modelos de Freundlich (a) y Langmuir (b) de forma lineal. Para el modelo de Freundlich la ecuación utilizada fue: Ln qe = Ln Kf + 1/n ln Ce , su ajuste se muestra ligeramente mayor que en el caso del modelo de Langmuir cuyos valores determinados son Kf : 2.3, referido a la constante de Freundlich y n: 4.5 que, en un rango de 2 a 10 representa una buena intensidad de adsorción y donde n > 1 que sugiere una interacción adsorbente-adsorbato, de tipo física [8]. Por otro lado, al ajustar con el modelo de Langmuir, imagen 3 b, con el cual, se obtuvo también un buen ajuste, de acuerdo a la ecuación lineal: 1/qe = 1/qmáx + 1/(qmáx KCe) donde qe representa la concentración del adsorbato en el adsorbente, Ce la concentración en el líquido, ambos en equilibrio y qmáx define la máxima capacidad de adsorción del adsorbente; se obtuvo qmáx= 14.9 mg Cr(III) gresina -1 , siendo la misma obtenida en el gráfico de equilibrio (imagen 2); KL= 0.84 (L/g), constante de Langmuir, parámetro relacionado con la energía de adsorción y permite evaluar esta isoterma a partir del factor adimensional RL con ecuación RL = 1/((1+KL)*Ci) donde Ci representa la concentración inicial y que muestra un valor de 7.25×10-3 donde valores 0 < RL <1 muestran un sistema isotérmico favorable [9]. En cuanto al pH, éste se mantuvo en un valor promedio de 3.4, debido al intercambio de la especie de Cr3+ con H+.
Para la remoción de Cr (VI), imagen 4, el equilibrio entre la concentración de éste en el sólido y líquido va en aumento, estabilizándose en un valor de 149 mg gresina -1. Al aplicar los modelos de Langmuir y Freundlich, imagen 5, puede observarse buen ajuste en ambas, siendo más favorecido en el caso del modelo de Langmuir, 5b. Del modelo de Freundlich, 5a, se obtuvo: Kf = 3.6 y n de 1.95 correspondiente a la intensidad de adsorción donde n>1, sugiriendo una interacción adsorbente-adsorbato de tipo física.
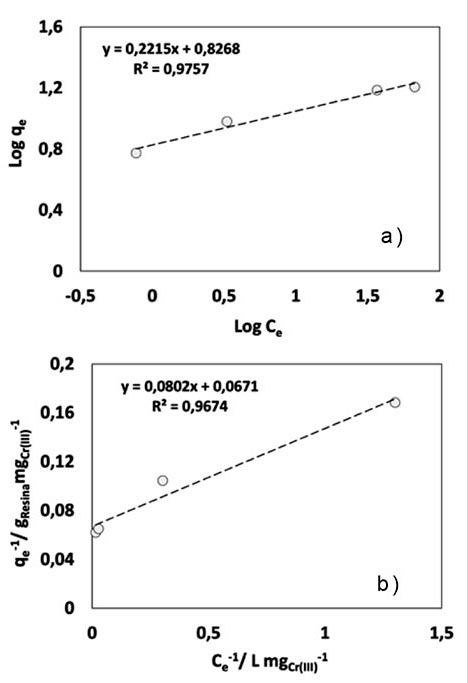
Imagen 3: a) Isoterma de Freundlich; b) Isoterma de Langmuir para analizar el intercambio iónico de Cr (III).
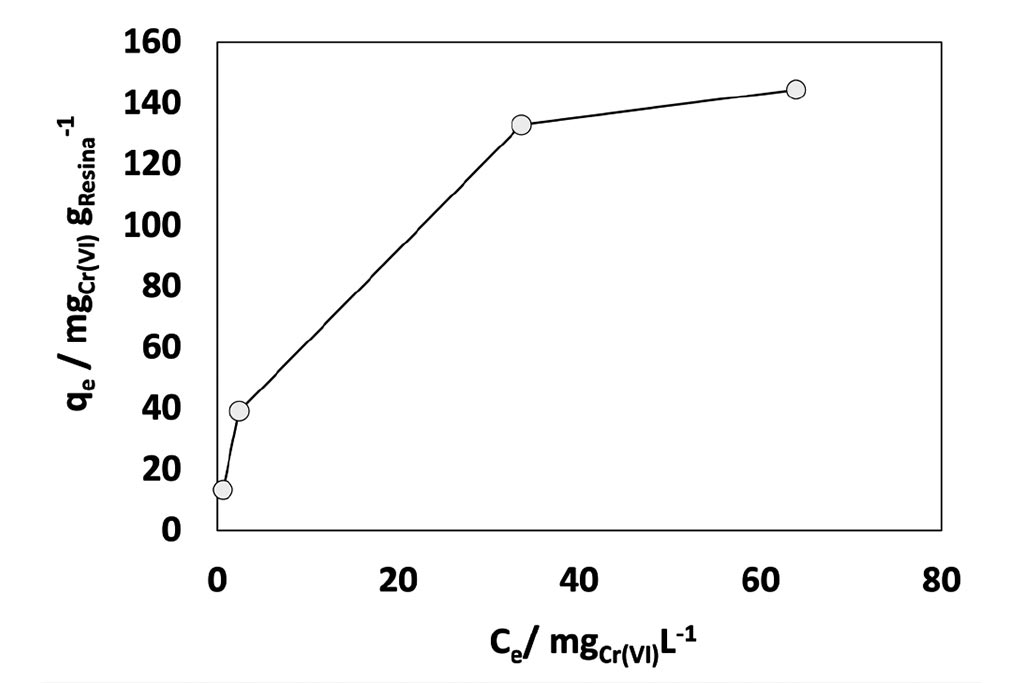
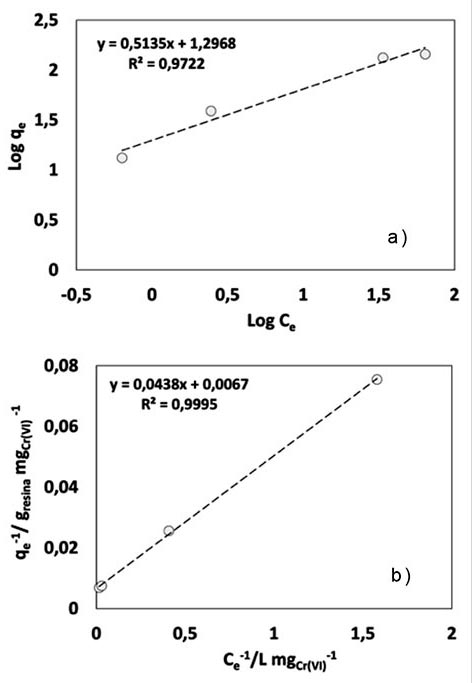
El ajuste al modelo de Langmuir, 5b, sugiere una qmáx= 149.25 mg Cr (VI) gresina-1 , KL de 2.93×10-4 (L/g) y RL =0.99. Se ha de mencionar que el pH se mantuvo entre 5.7 y 8.4 lo cual revela que la especie durante el intercambio, fue de manera predominante el CrO42-.
Cinética
La prueba de cinética para Cr (III) y Cr (VI) muestran que el proceso de intercambio se realiza al total a los 60 minutos, siendo ligeramente más rápido para Cr(III) aunque con mayor masa del intercambiador.
Conclusiones
Las isotermas de Frundlich y Langmuir se asocian como modelos adecuadamente a la remoción de Cr (III) y Cr (VI) en esta experiencia. Siendo la ressina IRA-900 altamente recomendable para la remoción de Cr (VI) por su alta capacidad. La relación adsorbente-adsorbato mantiene interacción física para ambas experiencias es así que se recomienda para procesos continuos por su factibilidad para la regeneración de resinas y reutilización.
Agradecimientos
Daniel Sebastian Pedraza Fonseca agradece al Comité de Veranos de la Universidad de Guanajuato por la oportunidad de investigación y la beca otorgada, al Depto. De Minas, Metalurgia y Geología por las facilidades en el uso de sus laboratorios, así como a la Dra. Lucía Alvarado por el gran acompañamiento a lo largo de la investigación, por último, pero no menos importante, al Técnico Académico Juan Carlos Martínez Barrón por su amabilidad y colaboración.
Referencias
- Costa, M. (2003). Potential hazards of hexavalent chromate in our drinking water. Toxicology and applied pharmacology, 188(1), 1-5
- Shi, T., Wang, Z., Liu, Y., Jia, S., & Changming, D. (2009). Removal of hexavalent chromium from aqueous solutions by D301, D314 and D354 anion-exchange resins. Journal of Hazardous Materials, 161(2), 900-906.
- Wang, W., Li, M., & Zeng, Q. (2015). Adsorption of chromium (VI) by strong alkaline anion exchange fiber in a fixed-bed column: experiments and models fitting and evaluating. Separation and Purification Technology, 149, 16-23.
- Šillerová, H., Komárek, M., Chrastný, V., Novák, M., Vaněk, A., & Drábek, O. (2013). Brewers draff as a new low-cost sorbent for chromium (VI): comparison with other biosorbents. Journal of colloid and interface science, 396, 227-233.
- Bhattacharya, P., Banerjee, P., Mallick, K., Ghosh, S., Majumdar, S., Mukhopadhyay, A., & Bandyopadhyay, S. (2013). Potential of biosorbent developed from fruit peel of Trewia nudiflora for removal of hexavalent chromium from synthetic and industrial effluent: Analyzing phytotoxicity in germinating Vigna seeds. Journal of Environmental Science and Health, Part A, 48(7), 706-719.
- Marzouk, I., Dammak, L., & Hamrouni, B. (2013). Adsorption of chromium onto activated alumina: kinetics and thermodynamics studies. Water Environment Research, 85(2), 99-104.
- Li, L., Fan, L., Sun, M., Qiu, H., Li, X., Duan, H., & Luo, C. (2013). Adsorbent for chromium removal based on graphene oxide functionalized with magnetic cyclodextrin–chitosan. Colloids and Surfaces B: Biointerfaces, 107, 76-83.
- Rivas, C. F., Núñez, O., Longoria, F., & Gonzalez, L. (2014). Isoterma de langmuir y freundlich como modelos para la adsorción de componentes de ácido nucleico sobre WO3. SABER. Revista Multidisciplinaria del Consejo de Investigación de la Universidad de Oriente, 26(1), 43-49.
- Larenas Uría, C. (2009). Estudio isotérmico de biosorción de plomo en aguas utilizando residuos vegetales.Revista Ciencias de la vida, 2(1), 3-8
1 Ingeniería Ambiental, Universidad Pedagógica y Tecnológica de Colombia
2 Departamento de ingeniería en Minas, Metalurgia y Geología, División de Ingenierías, Sede San Matías, Universidad de Guanajuato, Campus Guanajuato | lucia.alvarado@ugto.mx


















