Estudio de la depresión de pirita utilizando metabisulfito de sodio y dextrina en presencia de xantato amílico de potasio
Por: M.A. Corona-Arroyo*, K. Solorzano, C. Echeveste, M. Salazar-Hernández, I. López-Báez. L.G. Alvarado.
Resumen
La acción depresiva del metabisulfito y de la dextrina de forma individual y combinada sobre pirita con y sin presencia de xantato amílico se ha estudiado analizando el ángulo de contacto y la microflotación. Los estudios se realizaron a un pH de 8 buscando reducir el consumo de cal. Los resultados obtenidos indican que la combinación de MBS con DX redujeron la flotación y el ángulo de contacto de pirita más eficiente en comparación con su efecto individual. Además, se logró incrementar la depresión de pirita cuando el metabisulfito se añadió en presencia de aireación de la pulpa.
Palabras clave. Flotación, Pirita, Depresión, Oxidación, Metabisulfito de sodio, Dextrina.
Introducción
La pirita (FeS2) es uno de los sulfuros más abundantes en la corteza terrestre y generalmente presenta asociación con minerales valiosos como: la galena, carbón, oro, esfalerita y calcopirita (Mu et al., 2016a). Este mineral al poseer una importancia económica relativamente baja, por lo común, es deprimido en los procesos de flotación y procesado como material de desecho. Sin embargo, este proceso puede ser complejo debido a su facilidad para flotar con la calcopirita, galena y esfalerita, ocasionando que su presencia reduzca la concentración de los metales base y con ello disminuya la calidad del concentrado. En consecuencia, es fundamental la eliminación de pirita en el tratamiento de minerales sulfurados. Durante su flotación diferencial, surgen problemas de selectividad, que son consecuencia principalmente del comportamiento electroquímico de la pirita y de las texturas minerales que presentan los yacimientos procesados.
Hoy en día se han aplicado una gran variedad de métodos para separar los minerales de cobre, plomo y zing de la pirita. Regularmente se emplea el método de flotación de sulfuros con depresión de pirita en un medio alcalino. La búsqueda de depresores selectivos que depriman la flotación de pirita y que tengan escaso o nulo efecto sobre la flotación de los minerales de valor se ha convertido en una labor crítica. Recientemente, el problema del control de piritas se ha vuelto cada vez más importante en algunas unidades mineras ubicadas en los estados de Hidalgo, Zacatecas, Durango y San Luís Potosí, entre otros. Una de las condiciones asociadas al problema del control de pirita es el incremento en las leyes de cabeza, normalmente estas leyes pueden oscilar entre el 1 y 5%, aunque recientemente se están presentando cabezas de Fe superiores al 10%. Un inconveniente que se puede presentar en ciertas ocasiones es una baja de la liberación <70%, cuando esto se presenta se requiere de una molienda muy fina, sin embargo, normalmente con <75 micrómetros suele ser suficiente.
Hasta la fecha los reactivos inorgánicos que son utilizados comúnmente en la flotación de minerales de sulfuros de cobre a partir de la depresión de pirita son: la cal, dicromato de potasio, permanganato de potasio, peróxido de hidrógeno, hipoclorito de calcio, etcétera (Khoso et al. 2019). En el caso de la flotación de plomo, se tiene varios esquemas químicos para la separación de Pb-Fe, uno de ellos es el uso de NaCN y el uso de Cal. Si bien, estos reactivos resultan altamente eficientes en la depresión de pirita durante la flotación de los minerales de valor, es importante seguir en la búsqueda de depresores eficientes y amigables con el medio ambiente.
Los reactivos orgánicos o biopolímeros también son una alternativa en la depresión de pirita, como lo son: La dextrina (almidón, dextrina, carboximetilcelulosa y chitosan), poliacrilamidas (PAM), extractos de madera (lignosulfonatos) (Bulut et al., 2011; Mu et al., 2016b). Sin embargo, estos reactivos no han logrado sustituir por completo la combinación cianuro-cal, siendo muy amigables con el medio ambiente
El presente estudio de investigación de depresión de pirita se ha evaluado utilizando metabisulfito de sodio (MBS) o dextrina (DX) de forma individual y combinada buscando mejorar la depresión de pirita con reactivos que sean más amigables con el medio ambiente. Como parámetro fijo se empleó un pH de 8 para disminuir el consumo de cal. La evaluación se realizó a través de mediciones de ángulo de contacto y microflotaciones para conocer el efecto depresor combinado de ambos reactivos.
Metodología
Materiales
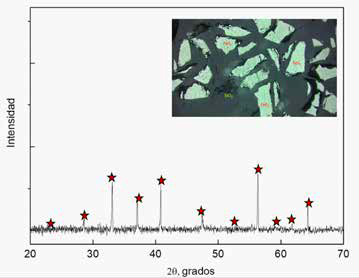
En esta investigación se utilizaron especímenes naturales de pirita de Guanajuato, México. Los especímenes fueron triturados y purificadas manualmente, se empleó un microscopio óptico para eliminar las impurezas, tales como: calcita, silicatos y otros sulfuros. Se utilizaron dos tipos de muestras, cristales de 1cm2 para la medición de ángulo de contacto y partículas de entre -100+75 µm para los estudios de microflotación. Las muestras de microflotación fueron caracterizadas mediante difracción de rayos X, microscopia óptica de luz polarizada y análisis químico por absorción atómica para determinar su pureza. La Figura 1 contiene el difractograma de rayos X de la muestra de pirita, en éste se observan los picos característicos de la pirita, además se ha incluido una imagen donde se observan cristales de pirita y algunas trazas de silicatos. De los análisis químicos se encontró un 45.11% de hierro, por lo que la concentración de pirita se estima en 97.22%.
El xantato amílico de potasio (PAX) industrial con una pureza del 94% fue utilizado como colector de pirita sin previa purificación. Se usó tapioca dextrina 12 (A. E. Stanley Manufacturing Company), y metabisulfito de sodio (J.T.Baker, grado analítico) como depresores. En todos los estudios se utilizaron soluciones de DX, MBS y PAX recién preparadas. Los experimentos se realizaron con una fuerza iónica constante de 1×10-3M de NaCl. El agua utilizada fue desionizada y el pH fue ajustado con soluciones diluidas de NaOH y HCl, todos estos reactivos fueron grado analítico.
Estudios de ángulo de contacto
Los estudios de ángulo de contacto sobre pirita en presencia de dextrina y metabisulfito de sodio se realizaron montando los cristales de los minerales en resina epóxica, desbastados con lijas de carburo de silicio, y finalmente pulidos a espejo. Los cristales fueron puestos en el sonicador por 5 minutos para remover cualquier partícula de reactivo o contaminante que pudiera interferir en la medición del ángulo de contacto. Inmediatamente después, las muestras fueron acondicionadas en solución acuosa con agua desionizada y con las condiciones químicas deseadas por un tiempo determinado (3-10 min).
En este estudio se evaluó el efecto individual de la adición de MBS y dextrina y el efecto de combinarlos. Durante el estudio de la mezcla de reactivos, se evaluó el efecto de la aireación en presencia del MBS para potenciar el efecto oxidante y después se añadió la DX.
El pH de la pulpa fue ajustado a 8 mediante la adición de soluciones acuosas de HCl y NaOH, posteriormente se añadió el depresor (MBS, DX) y se puso en contacto por 10 minutos para medir el ángulo de contacto. Cuando se usaron los dos depresores, siempre se acondicionó primero con MBS y después con DX. Como último paso en el procedimiento, se añadió PAX a una concentración deseada y se dejó reaccionar por 5 minutos. Durante todo el proceso de acondicionamiento se midió el potencial óxido-reducción de la pulpa (ORP) utilizando un electrodo de platino acoplado con una referencia de Ag/AgCl saturada. El acondicionamiento se llevó a cabo en una celda de vidrio, se lo colocó una burbuja de 1mm de diámetro utilizando una microjeringa (Hamilton de 0.10 ml, syringe serie 700) con forma de gancho. La sombra de la burbuja en equilibrio con el cristal y la solución acuosa fue fotografiada, posteriormente procesada con el analizador de imágenes ImageJ y el plugin Contact-Angle (Brugnara, 2006) para la obtención del ángulo de contacto. Se colocaron 3 burbujas para cada medición y se reportó el ángulo promedio como medida final. La Figura 2 muestra un esquema del equipo utilizado.

mediante la técnica de burbuja cautiva.
Estudios de Microflotación
Los estudios de microflotación se llevaron a cabo utilizando un tubo Hallimond. Se utilizó un gramo de pirita o galena con tamaños de partícula de -100+75 micrómetros en una suspensión de 100 ml de agua desionizada. Los minerales fueron acondicionados siguiendo la secuencia de adición de reactivos como en las pruebas de ángulo de contacto, es decir, se añadieron primero los depresores y posteriormente el colector. Una vez terminado el tiempo de acondicionamiento, las dispersiones fueron transferidas al tubo de flotación y flotadas durante 1 minuto con un flujo constante de 30 ml/min de nitrógeno de alta pureza. Finalizada la prueba, la flotabilidad fue calculada por diferencia de peso.
Resultados y discusión
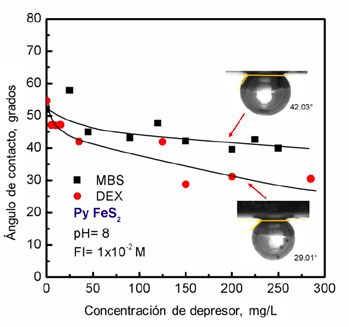
La Fig. 3 muestra el ángulo de contacto de pirita en función de la adición del depresor MBS y DX en forma individual y sin colector. Sin la adición de depresor, el ángulo de contacto natural de la pirita alcanza su valor más grande, este ángulo se va reduciendo con el incremento de dosificación de la mezcla de MBS/DX. El ángulo de contacto natural de la pirita a pH 8 tiene una reducción en presencia de MBS, éste se reduce de 54.70º a 42º cuando alcanza la máxima dosificación utilizada. Del mismo modo, la pirita en presencia de DX a 300 mg/l tiene una reducción máxima alrededor de 29°, siendo un poco más efectiva en la reducción de la mojabilidad de la pirita que el MBS. Dávila-Pulido et al. (2011) mencionan que la depresión de pirita por MBS es debido a la oxidación de las especies de Fe presentes en la superficie del mineral, la cual vuelve hidrófila a la pirita, reduciendo su flotabilidad. Sin embargo, ambos depresores no son lo suficientemente eficientes como para deprimir completamente la hidrofobicidad natural de la pirita en pequeñas dosificaciones.
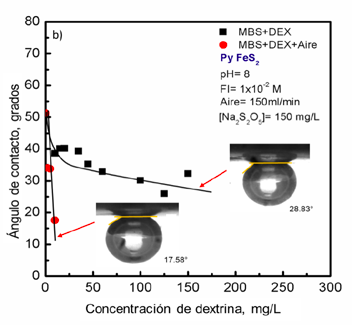
El siguiente experimento propuesto para incrementar la depresión de pirita consistió en evaluar el efecto combinado de los dos depresores manteniendo constante la concentración de MBS con y sin aireación de la pulpa. En la Figura 4 se observa que cuando no se utilizó aireación, el efecto combinado de los depresores al incrementar la DX redujo más rápidamente el ángulo de contacto en comparación con los depresores evaluados de forma individual (véase la Figura 3).
La caída del ángulo de contacto de pirita es notable a partir de 60 mg/L de DX al estar en presencia de MBS, alcanzando un valor de 28.83º cuando la dosificación de DX es de 150 mg/L. Como siguiente etapa de evaluación, se realizó la aireación de la pulpa (150 ml/min de aire) antes de añadir los depresores, la idea es tener oxígeno disponible durante el acondicionamiento con el MBS de acuerdo con Dávila-Pulido et al. (2011). Este proceso resultó más eficiente en la reducción del ángulo de contacto. El valor del ángulo de contacto para el cristal de pirita a una concentración de 10 mg/L de DX fue de 17.58º, siendo una medición difícil de obtener por ser un ángulo muy pequeño. Los resultados obtenidos comprueban que la presencia de oxígeno disponible para reaccionar con MBS es muy importante. Como se puede observar (Figura 4), los círculos rojos muestran una pendiente más pronunciada en la caída del ángulo de contacto de pirita utilizando el siguiente esquema: aireación + MBS + DX. Lo que se buscó con esta secuencia es oxidar la superficie para tener una mayor adsorción de DX.
y DX con y sin aireación de la pulpa y sin colector (150 ml/l de aire).
La Figura 5 muestra el rendimiento de flotación de pirita en función de la adición de DX y MBS de forma individual y de forma combinada en presencia de PAX, respectivamente. La pirita exhibió buena flotabilidad en todo el intervalo de dosificaciones estudiadas de depresores, debido a que la hidrofobicidad establecida por el PAX no pudo ser inhibida por las adiciones de los depresores en forma individual (véase la Fig. 5a). Esto confirma el comportamiento en la baja reducción de mojabilidad presentada en la Figura 3. Por otro lado, la Fig. 5b muestra la flotabilidad de pirita en función de la concentración de DX a una concentración constante de 150 y 1000 mg/L de MBS (efecto combinado de depresores) con oxigenación de pulpa. Cuando se utilizan 150 mg/L de MBS con aire se puede observar que la pirita presenta una rápida reducción de la flotabilidad hasta alcanzar un valor de 45.85% con una concentración de 25 mg/L de DX. Además, se observa que la flotabilidad de la pirita a dosificaciones mayores a 25 mg/L de DX se recupera la flotabilidad inicial.
Por el contrario, cuando se utilizó aire con 1000 mg/L de MBS se tuvo una depresión considerable de pirita (véase la Fig. 5b). Estos resultados muestran que el efecto combinado de los depresores redujo la flotabilidad de la pirita considerablemente y esta depresión, no se logra cuando los reactivos son añadidos en forma individual.
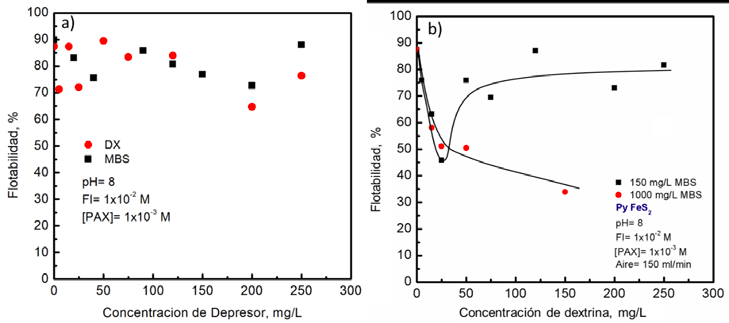
Figura 5. Microflotación de concentración de DX y MBS a pH de 8 en presencia de 1X10-3M de PAX. a) Flotabilidad de pirita en función de la concentración de los depresores de forma individual, b) Flotabilidad de pirita en función de la concentración de DX a 150 y 1000 mg/L de MBS con aireación de pulpa (150 ml/l de aire).
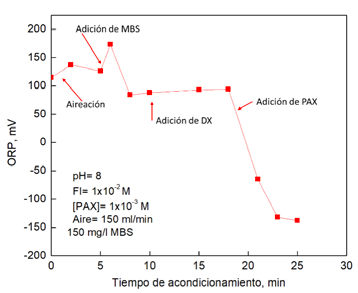
La Figura 6 muestra la medición del ORP durante el tiempo de acondicionamiento de la pirita para las pruebas de microflotación. Puede observarse que el ORP aumenta al iniciar la aireación de la pulpa, minutos después se añade la solución de MBS, se observa un incremento de ORP y posteriormente disminuye. A los10 minutos se adiciona DX sin observarse un cambio significativo en el ORP. Cuando se adiciona PAX, el ORP tiene una disminución significativa hasta aproximadamente -150 mV.
El comportamiento del ORP puede justificarse con fenómenos de oxidación de especies. Se ha reportado que el ion sulfito se oxida a sulfato (reacciones 1-3), y de acuerdo con Connick et al. (1995) y Mu et al. (2019) se tiene unas reacciones intermedias de propagación donde se forman radicales que son oxidantes (reacciones 4-6).
S2O52- + H2O = 2SO32- + 2H+ (1)
SO32- + 2O2(ac) = SO42- (2)
S2O52- + O2(ac) = 2SO42- + H2O (3)
*SO3- + O2(ac) → *SO5- (4)
*SO5– + SO32- →SO52- + *SO3- (5)
El pico o incremento del ORP en la Figura 6 después de añadir el MBS puede estar asociado a los radicales que se forman en las reacciones 4 y 5. Brandt and Van Eldik (1995) and Mu and Peng (2019) sugirieron la formación de estos radicales (*SO5−) oxidantes y demostraron la formación de especies oxidadas sobre la superficie de los minerales. En el presente trabajo se sugiere que el MBS oxida la superficie acelerando la caída del ángulo de contacto y la hidrofobicidad de la pirita. La oxidación de la superficie de pirita favorece la adsorción de DX, por lo cual se puede incrementar el proceso de depresión de pirita.
Conclusiones
En este trabajo, se estudió el efecto depresor del MBS y DX de forma individual y combinada sobre la flotabilidad de pirita. Los resultados mostraron que se tiene una mayor depresión de pirita cuando los depresores se añaden en forma combinada, siendo importante añadir primeramente el MBS y después la DX. La depresión de pirita es más efectiva cuando la adición de MBS se añade en un ambiente con oxígeno disponible, por lo que es importante oxigenar la pulpa.
Agradecimientos
Los autores agradecen a. Consejo Nacional de Ciencia y Tecnología, México (CONACyT) por la Beca de K. Solorzano y C. Echeveste y por el apoyo económico a través del proyecto A1-S-9361, Universidad de Guanajuato, México. También al laboratorio LICAMM, Universidad de Guanajuato, México por los análisis de Difracción de Rayos-X en la caracterización de los minerales usados en esta investigación.
Referencias
- Brandt, C., Van Eldik, R., 1995. Transition metal-catalysed oxidation of sulphur (IV)oxides. Atmospheric relevant processes and mechanisms. Chem. Rev. 95, 119–190.
- Brugnara, M. (2006). Contact Angle. https://imagej.nih.gov/ij/plugins/contact-angle.html
- Bulut, G., Ceylan, A., Soylu, B., Goktepe, F., 2011. Role of starch and metabisulphite on pyrite and pyritic copper ore flotation. Physicochem. Probl. Miner. Process 48, 39–48.
- Dávila-Pulido, G.I., Uribe-Salas, A., Espinosa-Gómez, R., 2011a. Comparison of the depressant action of sulfite and metabisulfite for Cu-activated sphalerite. Int J Miner Process 101, 71–74. https://doi.org/10.1016/j.minpro.2011.07.012
- Khoso S.A., Gao Z., Tian M., Hu Y., and Sun W., 2019. Adsorption and depression mechanism of an environmetally friendly reagent in differential flotation of Cu-Fe sulphides. Journal of Materials Research and Technology 8, 5422-5431.
- Mu, Y., Peng, Y., 2019. The role of sodium metabisulphite in depressing pyrite in chalcopyrite flotation using saline water. Miner Eng 142. https://doi.org/10.1016/j.mineng.2019.105921
- Mu, Y., Peng, Y., Lauten, R.A., 2016a. The depression of pyrite in selective flotation by different reagent systems – A Literature review. Miner Eng. https://doi.org/10.1016/j.mineng.2016.06.018
- Mu, Y., Peng, Y., Lauten, R.A., 2016b. The mechanism of pyrite depression at acidic pH by lignosulfonate-based biopolymers with different molecular compositions. Miner Eng 92, 37–46. https://doi.org/10.1016/j.mineng.2016.02.007
Departamento de Ingeniería en Minas, Metalurgia y Geología, División de Ingenierías, Universidad de Guanajuato. Ex-Hacienda de San Matías S/N. Guanajuato, Gto, 36020 México. Guanajuato 36000, México
*Corresponding author e-mail: m.corona@ugto.mx


















