Recuperación de oro en un sistema yodo-yoduro comparado a la cianuración
Por: José Guadalupe Moreno Cedillosa, Francisco Raúl Carrillo Pedrozaa, Ma. De Jesús SoriaAguilara, Juan Antonio González Anayab
Resumen
La lixiviación es una técnica de recuperación de materia, en la cual es posible obtener el oro presente en un mineral a través de un ataque con diferentes agentes químicos. De diversos métodos existentes, el más utilizado ha sido la cianuración desde hace más de 100 de años, pero, las malas prácticas de operación, el tiempo tardío de recuperación y la mineralogía compleja (acompañamiento de sulfuros y óxidos de hierro) han puesto en marcha el estudio de diferentes sistemas lixiviantes alternativos. En ese sentido, se plantea la necesidad de generar el conocimiento fundamental que permita valorar y evaluar la posibilidad de extraer metales de interés como el oro mediante una técnica de yoduración, la cual no ha sido estandarizada.
Dicha técnica propone menos riesgos por las malas prácticas operacionales, una selectividad específica para metales preciosos de interés (oro y plata), además, obtención de una tasa similar de recuperación en comparativa al sistema convencional de la cianuración.
Para el caso particular de este estudio el rendimiento de extracción de oro se realizó con pruebas químicas, físicas y analíticas, utilizando un mineral proveniente de la industria minera asociado a hematita. El tamaño de partícula fue de (180 µm), obtenido después de un proceso de molienda y tamizado. Las pruebas se realizaron en un tiempo de 60 minutos a 60°C con un pH de entre 6 y 7 a 1200 rpm para el caso de yoduración, mientras que en la cianuración se modificó el tiempo a 3 horas y un pH entre 10 y 12. Los análisis de los productos se llevaron mediante la técnica de Absorción Atómica. Los resultados posteriores a la lixiviación en el sistema de yoduración muestran que se obtuvieron porcentajes de recuperación desde 86.27 hasta 99.92%.
Palabras clave: lixiviación, mineralogía, cianuración, yoduración.
Abstract
Leaching is a technique of material recovery, in which it is possible to obtain the gold present in a mineral through an attack with different chemical agents. Of several existing methods, the most used has been cyanidation for more than 100 years, but, the bad operation practices, the late recovery time and the complex mineralogy (accompanying sulfides and iron oxides) have set in motion the study of different alternative leaching systems. In this sense, there is a need to generate the fundamental knowledge to assess and evaluate the possibility of extracting metals of interest such as gold by means of an iodidation technique, which has not been standardized. This technique proposes less risks due to bad operational practices, a specific selectivity for precious metals of interest (gold and silver), in addition, obtaining a similar recovery rate compared to the conventional cyanidation system. For the particular case of this study, the gold extraction performance was carried out with chemical, physical and analytical tests, using an ore from the mining industry associated with hematite. The particle size was (180 µm), obtained after a grinding and sieving process. The tests were carried out in a time of 60 minutes at 60°C with a pH between 6 and 7 at 1200 rpm in the case of iodination, while in cyanidation the time was modified to 3 hours and a pH between 10 and 12. The results after leaching in the iodination system show that recovery percentages ranging from 86.27 to 99.92% were obtained.
Key words: leaching, mineralogy, cyanidation, iodidation.
Introducción
En los últimos años debido al desarrollo económico global, la demanda de oro ha crecido en gran medida, ante esta situación existe la necesidad de diversas tecnologías de recuperación de metales preciosos. En la hidrometalurgia del oro, la técnica de cianuración es ampliamente utilizada por la industria minera, ha sido así desde hace más de un siglo en las diferentes menas de oro de todo el mundo (Altansukh et al., 2019), en las últimas décadas las leyes de los yacimientos para extracción de oro han estado cayendo, los minerales de interés se encuentran acompañados de óxidos de hierro o sulfuro complicando la extracción efectiva y sencilla (Medina & Anderson, 2020).
Otro factor metodológico importante es el tiempo de disolución de oro en el medio, provocando jornadas de operación largas (Isaia et al., 2017), diferentes agentes lixiviantes alternativos al uso del cianuro han sido estudiados e implementados en pruebas preliminares por diversos investigadores, de las múltiples alternativas propuestas, los halógenos han mostrado resultados prometedores debido a su alta selectividad y eficiencia en la disolución de metales preciosos de interés, con una velocidad de reacción rápidas (Khaing et al., 2019), de los halógenos, el yodo forma el complejo más estable con el oro en solución acuosa, esto se debe a los iones complejos de yodato de oro, los cuales tienen menor potencial redox en comparación con otros complejos halogenados.
Desde la década de los 70´s (Wilson, 1974) propuso un sistema de extracción mediante un sistema halógeno-halogenuro (yodo en solución de yoduro), comprobando la disolución de oro en estos medios. Siguiendo tal fundamento, se han realizado estudios recientes en los que se han reportado resultados favorables de extracción, siendo la matriz procedente materiales procesados como chatarra electrónica, virutas de oro, y mineral tostado. Este sistema se ha catalogado como aceptable, presentando una cinética de reacción muy rápida, excelente adaptabilidad en diferentes rangos de temperatura que van desde los 20°C hasta los 80°C, selectividad para metales preciosos de interés y estabilidad del ion AuI2– que va desde 1 hasta 10 en la escala de pH.
El lugol es un reactivo químico conocido como tintura de yodo, en términos generales, es disolución de yodo con yoduro de potasio. En sus inicios fue utilizado para el tratamiento de algunas enfermedades, actualmente también tiene aplicación en la biología molecular (Martín-Sánchez et al., 2013), debido a su composición, las especies químicas presentes en el medio son útiles como un sistema lixiviante, de esta manera se ve involucrado un halógeno-halogenuro.
Química de la disolución de oro en una solución con yodo
La disolución del oro en una solución de yodo-yoduro se define como una reacción de óxido-reducción (rédox), y la manera de representarse es en una celda electroquímica, en la cual interactúan 2 tipos de reacciones químicas (catódicas y anódicas). Este proceso inicia con la formación del ion I3– como (Davis et al., 1993) lo representó en la siguiente ecuación :
I2(ac) + I–(ac) ↔ I3–(ac) (Ec. 1)
La formación del ion I3– aumentará la solubilidad del I2 a nivel molecular en la solución acuosa, a medida que el ion I– incrementa en su concentración.
Las reacciones electroquímicas propuestas a continuación muestran el I3– como un agente oxidante.
Au(s)+2I–(ac) → AuI2–+ e– (reacción anódica) (Ec. 2)
Au(s)+4I–(ac) → AuI4–(ac)+ 3e– (reacción anódica) (Ec. 3)
I3–(ac) +2e– ↔ 3I–(ac) (reacción catódica) (Ec. 4)
2Au(s)+ I3–(ac)+ I–(aq) → 2AuI2–(ac)
2Au(s)+ I3–(ac) → 2AuI4–(ac)+ I–(aq)
En el sistema yodo-yoduro, I3– es el ion crucial, debido a que actúa como el agente oxidante para la oxidación del oro elemental en el complejo Oro (I)-yoduro, (Liang & Li, 2019) demostraron que en todo el sistema las condiciones de reacción están depedientes a la generación del ion I3– ; de acuerdo con el análisis termodinámico y electroquímico el oro metálico es oxidado para producir AuI2– y AuI4–. El AuI2– es más estable, y dicha estabilidad confiere su propiedad a una condición de un rango de pH de 0 a 12, y se obtiene un potencial eléctrico de comparándolo con el potencial eléctrico del oxidante 0.5316 V .
La formación del complejo entre yodo y oro (AuI2–) se muestra en la figura 1, en donde es posible observar que la condición para que se forme en un medio acuoso será posible en un rango amplio de pH que va desde 1 hasta 9, y en medios completamente bajos se puede empezar a dificultar su formación.
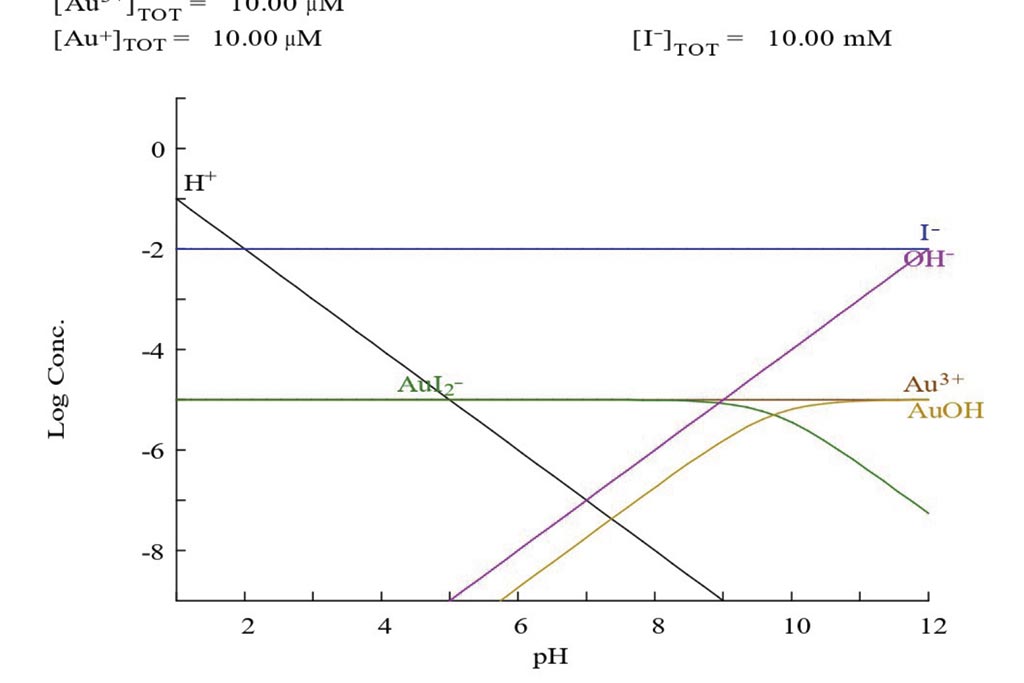
Química de la disolución de oro en una solución con cianuro
En el proceso de cianuración del oro se han propuesto múltiples teorías químicas para demostrar cómo es que ocurre el proceso. (Elsner, 1846) demostró que es de vital importancia la presencia de oxígeno para retener el oro en la solución cianurada. Tal como se presenta en la siguiente ecuación:
4Au+8NaCN+ O2+2H2O → 4NaAu(CN)2+4NaOH (Ec. 5)
Janin (1888), propuso con estudios que durante la cianuración se generaba gas hidrógeno y es representado en la ecuación 6:
2Au+4NaCN+ 2H2O → 2NaAu(CN)2+2NaOH+ H2 (Ec. 6)
Pese a esto Maclaurin y Christy (1893), rechazaron dicha teoría debido a que en aspectos termodinámicos no era posible y la teoría de Elsner fue rechazada, como se muestra en las ecuaciones 7 y 8.
2Au+4NaCN+O2+2H2O → 2NaAu(CN)2+2NaOH+ H2O2 (Ec. 7)
H2O2+2Au+4NaCN → 2NaAu(CN)2+2NaOH (Ec.8)
En la figura 2, podemos observar que el compuesto entre el cianuro y el oro (Au(CN)2–) se obtiene en pH completamente básicos.
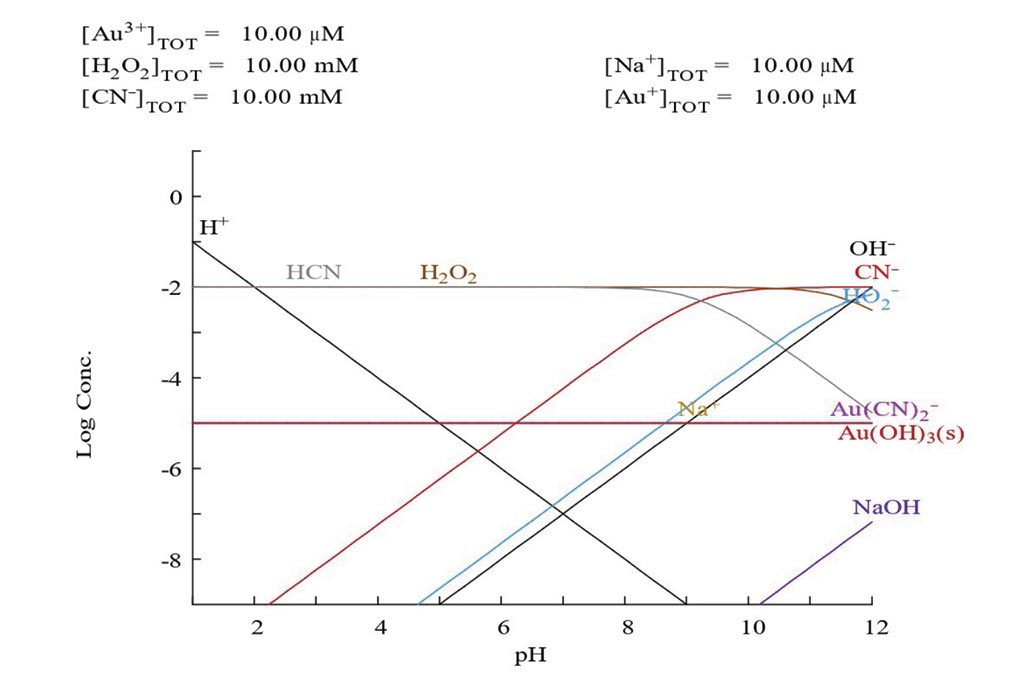
Metodología
Preparación de muestras
Los minerales utilizados en este proyecto se obtuvieron procedente de la industria minera como un producto de flotación, las características del mineral son asociados a hematita, se tiene como datos procedentes de las cabezas los siguientes: Muestra I 44 g/Ton, muestra II 22 g/Ton y muestra III 66 g/Ton.
Se realizó la distribución de tamaño de partículas del concentrado mineral con mallas Tyler, en este caso No. 80 (180 µm), con la finalidad de hacer la disolución del mineral más efectiva.
Yoduración
Los reactivos utilizados para el estudio fueron Lugol comercial, KI y agua destilada, la solución preparada es de 0.03 M. El proceso de recuperación se llevó a cabo en vasos de precipitado de 400 mL y la muestra requerida para cada prueba fue de 50 g, previamente seca, molida y tamizada.
La solución se mantuvo una temperatura constante de 60 °C a 1200 r.p.m. con agitación magnética durante 60 minutos. Durante todo el proceso de lixiviación en medio yodo-yoduro el valor registrado fue de pH 6 y 7. La solución resultante fue filtrada recuperando la muestra sólida y liquida, para su posterior cuantificación y caracterización.
Cianuración en caliente
Se preparó una solución 4 M de NaOH, al disolverse completamente se agregó NaCN en proporción 0.6% p/v y mineral al 25% p/v. El proceso se llevó a cabo en un vaso de precipitado, a 60 °C por 3 horas a una revolución de 1200 r.p.m., es importante tener cuidado con los vapores generados de cianuro. Una vez pasadas las 3 horas se filtró recuperando sólido y líquido.
Caracterización por absorción atómica
La técnica de absorción atómica sirvió para la determinación de Au presente en las muestras en cada sistema lixiviante, la presencia de Au fue posible en todas las muestras analizadas, cabe destacar que esta técnica se empleó para conocer cuánto porcentaje de Au se recuperó y, de esta manera identificar el efecto de cada sistema lixiviante. Para el análisis se utilizó el equipo de absorción atómica (Varían SpectrAA 220FS, France) con los parámetros de soluciones estándar de ppm para determinación Au.
Cálculo económico
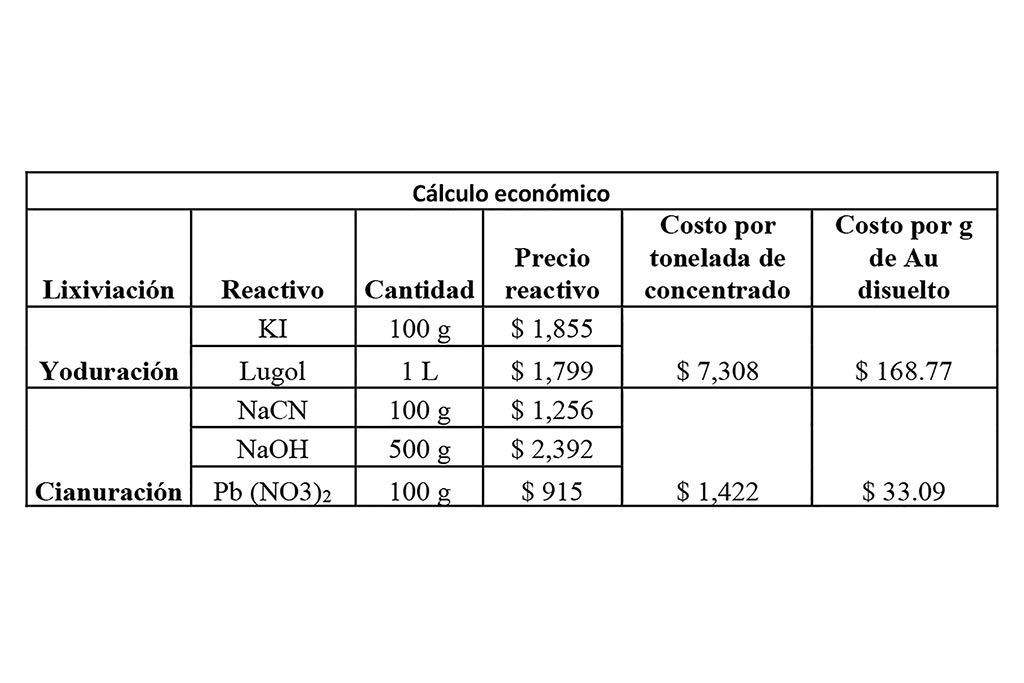
Se realizó con la verificación de precios en Sigma-Aldrich el día 8 de febrero de 2022, con base en los reactivos cuantificados y utilizados en ambos sistemas, para fines de este estudio no se tuvieron en cuenta gastos de consumo energético.
Resultados
En la Tabla 1 se muestran los resultados de los contenidos de oro del mineral en las muestras en ppm, calculado por la expresión:
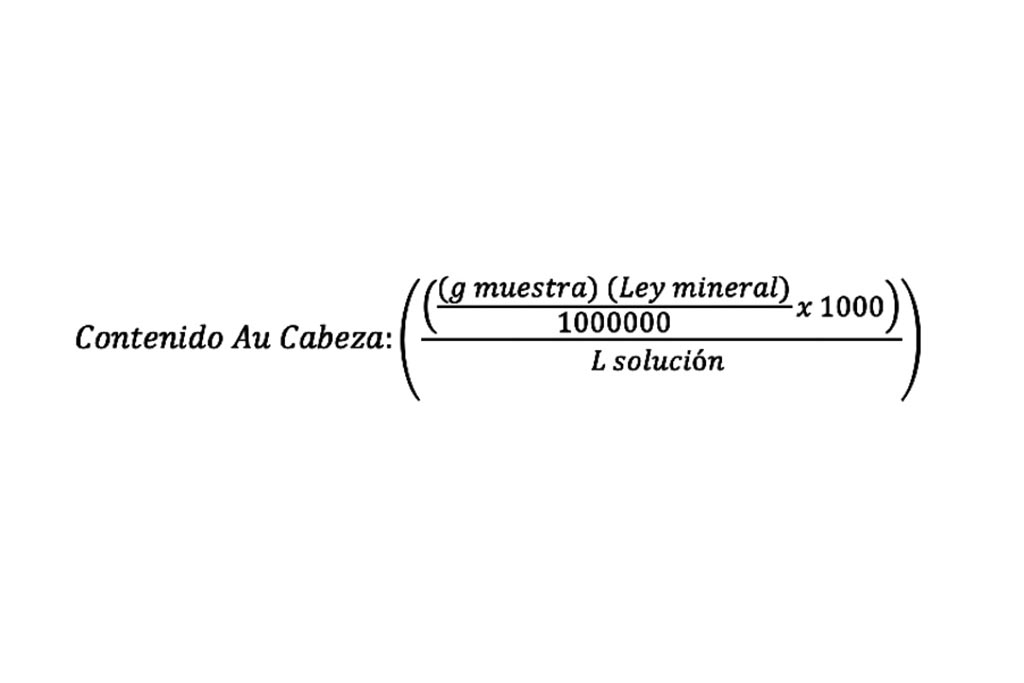
El líquido resultante de las lixiviaciones fue analizado por absorción atómica y se obtuvieron los datos representados en la tabla 2.
Se determinó el porcentaje de recuperación con ayuda del siguiente cálculo (Ribeiro et al., 2019), la información se puede observar en la Tabla 4 y Figura 3.

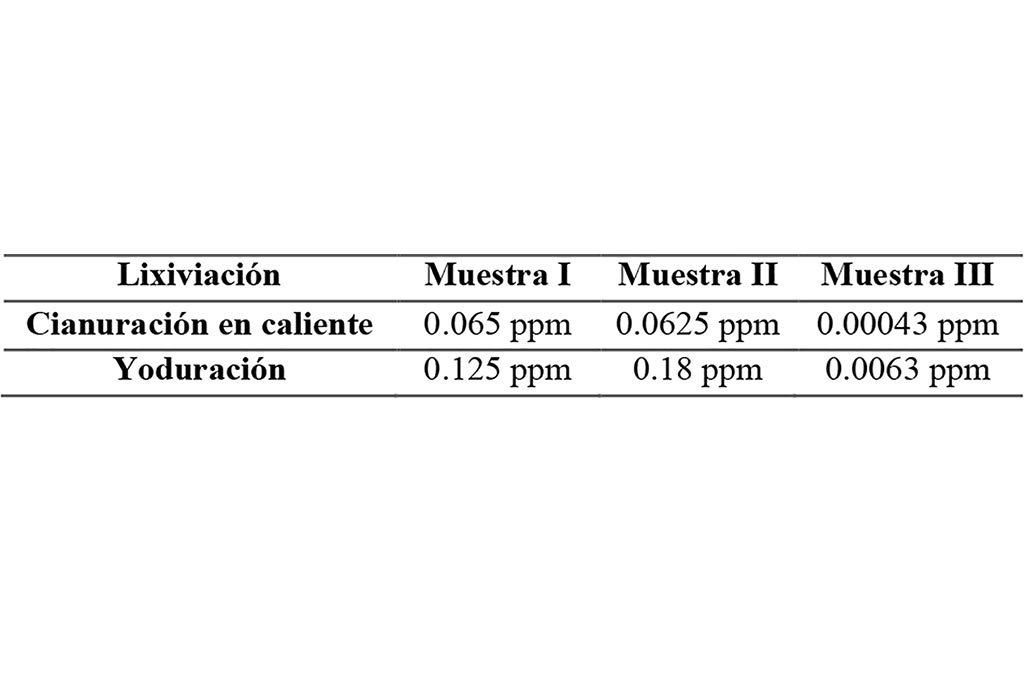
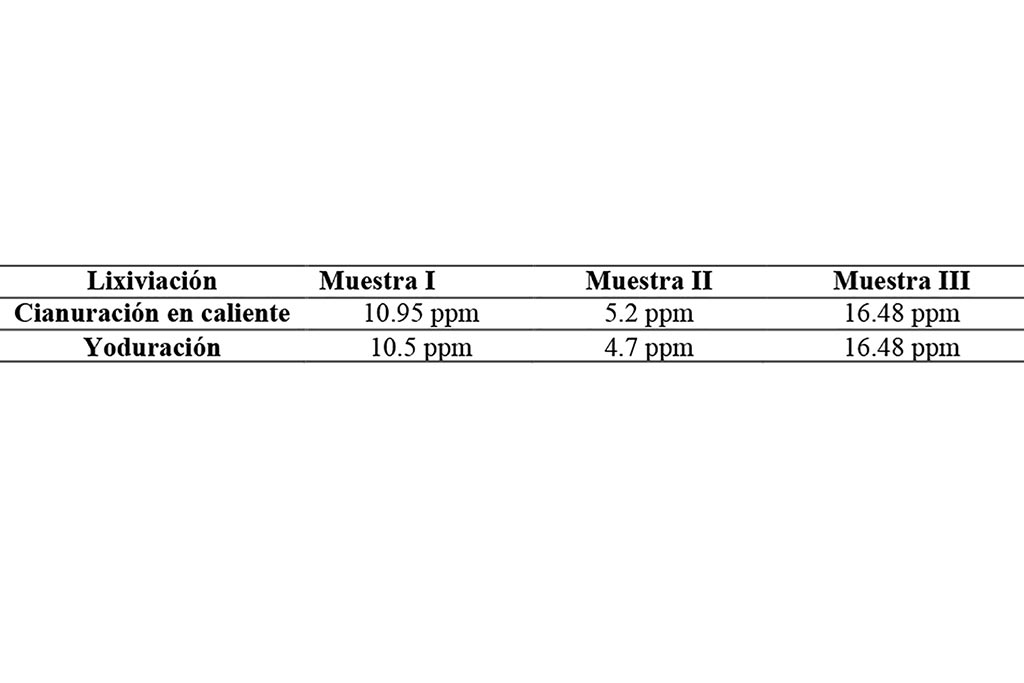
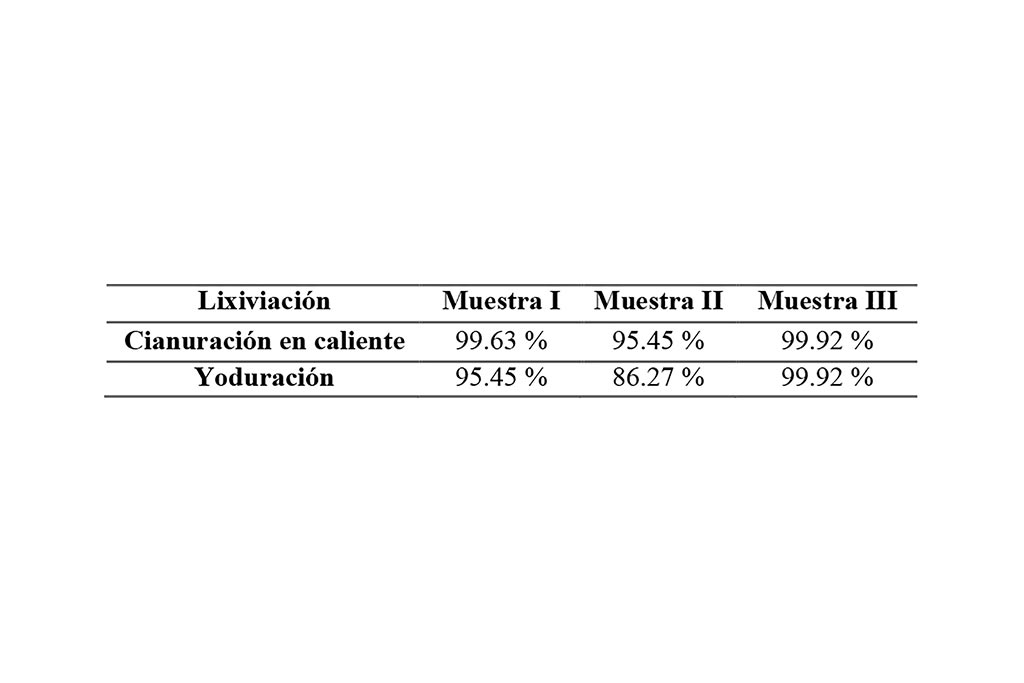
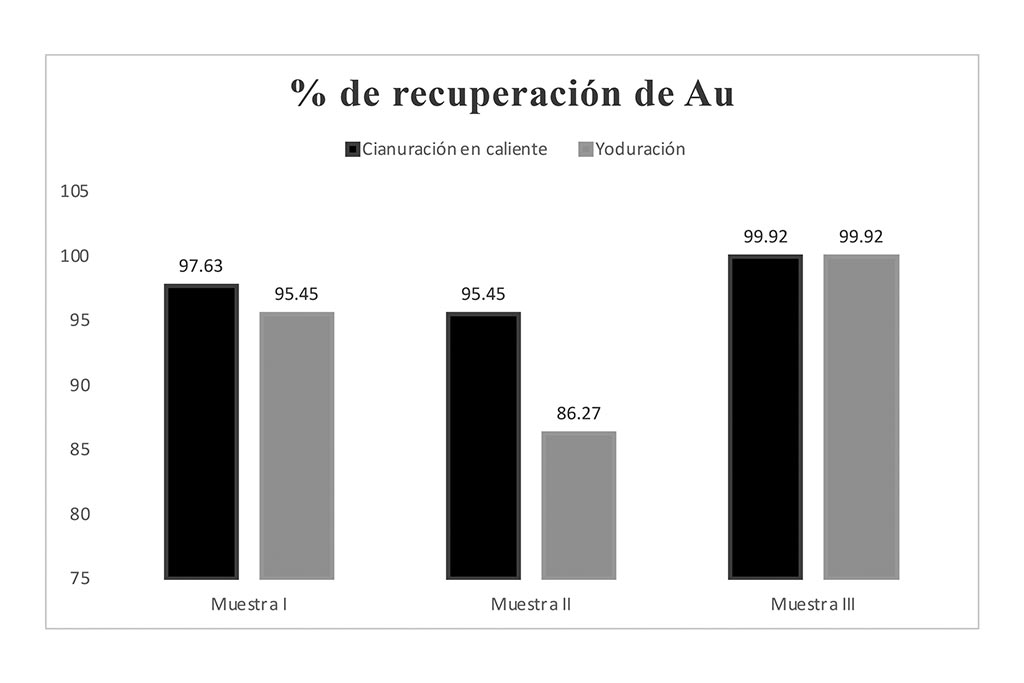
Figura 3. Comparación del % de recuperación de Au en sistemas lixiviantes(yoduración y cianuración)
Discusión de Resultados
Los datos obtenidos fueron posibles a través del método de absorción atómica solamente, y reflejan una lixiviación efectiva de un mineral de origen no refractario, en el caso del sistema de yoduración fue realizada en lapsos de 60 minutos mientras que por su parte la cianuración se realizó en 3 horas, para la muestra I se indica una extracción con diferencia de un 2% en ambos sistemas lixiviantes, siendo la cianuración el que obtuvo una tasa de recuperación más alta con 97.63 % mientras que en la yoduración 95.45%.
Es importante aclarar que estos sistemas obedecen una cinética en la cual el agente oxidante I3–(ac) complejo de halógeno logró complejar mediante el agente oxidante de manera más rápida el oro presente en el mineral, mientras que el cianuro obedece una cinética más lenta (Sousa etal., 2021).
En la muestra II la cianuración sigue siendo el sistema lixiviante con la mayor tasa de recuperación teniendo un 95.45%, frente a la yoduración con 86.27%, la única diferencia es la ley del mineral, el cual podría estar asociado a otros minerales que interactúen con el yodo para formar complejos, teniendo una menor extracción.
La muestra III nos reveló un porciento de recuperación igual entre ambos sistemas lixiviantes; generalmente una de las razones por las que la cianuración presenta ser mejor candidato es debido a la cantidad de reactivo utilizado durante el proceso de recuperación (Altinkaya et al., 2020).
De acuerdo con el análisis económico de ambos sistemas, el uso del cianuro sigue siendo el más económico, debido a que su coste es cinco veces menor. Es importante tomar en cuenta que ambas lixiviaciones tuvieron resultados similares con la diferencia que la cianuración le tomó el triple de tiempo frente a la yoduración; su porcentaje de recuperación indica la posibilidad de reutilización de reactivos en posteriores campañas de extracción como lo describe (Meng et al., 2020). Los resultados de los análisis mostrados en la Tabla 5 no deben tomarse como definitivos, siendo que nos muestran datos preliminares del tema de estudio, y no se han incluido parámetros que tienen importante relevancia en la reducción de costos, sobre todo aunados a la reutilización del medio lixiviante, tipo de reactivos y tecnología implementada.
Conclusión
- Los porcentajes de recuperación obtenidos en las 3 muestras en los diferentes sistemas lixiviantes fueron exitosos, debido a que se extrajo más del 80% del oro contenido en el mineral, bajo las condiciones delimitadas por sus cinética y termodinámica.
- Los resultados de las lixiviaciones de los métodos alternos nos muestran que, sí es posible competir contra el método de cianuración, pero es importante conocer las condiciones óptimas de reacción, por lo cual se propone un estudio cinético para optimización del proceso de lixiviación mediante el uso de ambos sistemas.
- Se obtuvo una amplia ventaja en tiempos de operación, la cianuración efectiva emplea 72 horas en escalas industriales, debido a su cinética, mientras que la lixiviación con yoduración nos muestra resultados favorables en 60 minutos, el triple del tiempo empleado en el sistema comparado; teniendo resultados muy similares, sin contar que los efluentes no son igual de contaminantes que los producidos por el método convencional, y pese a que existe una metodología implementada para el manejo de dichos residuos no deja de ser sumamente peligroso.
- Aunque los métodos alternos presentan propiedades muy atractivas aún se tiene que competir contra la cianuración a un nivel económico, sobre todo tomando en cuenta que se pueden reducir costes por tiempos de producción, por la reutilización del sistema yodo-yoduro en diferentes campañas de extracción de manera sencilla, en comparación a otros sistemas que requieren el uso de tecnología, agentes químicos y tiempo prolongado, por esa razón, es indispensable el estudio de los agentes oxidantes producidos en las lixiviaciones con halógenos, esto permitirá reducir costos significativamente, con la finalidad de poder escalar en las diferentes etapas teniendo un resultado de costo real por campaña de lixiviación y poder ser implementado en las minas en años futuros.
Agradecimientos
Moreno Cedillos agradece al CONACYT por la Beca otorgada para realizar sus estudios de posgrado, dentro del Programa de Maestría en Ciencia y Tecnología de la Metalurgia Universidad Autónoma de Coahuila.
Referencias
- Altansukh, B., Haga, K., Huang, H. H., & Shibayama, A. (2019). Gold recovery from waste printed circuit boards by advanced hydrometallurgical processing. Materials Transactions, 60(2), 287–296. https://doi.org/10.2320/matertrans.M2018328
- Altinkaya, P., Wang, Z., Korolev, I., Hamuyuni, J., Haapalainen, M., Kolehmainen, E., Yliniemi, K., & Lundström, M. (2020). Leaching and recovery of gold from ore in cyanide-free glycine media. Minerals Engineering, 158(August), 106610. https://doi.org/10.1016/j.mineng.2020.106610
- Davis, A., Tran, T., & Young, D. R. (1993). Solution chemistry of iodide leaching of gold. Hydrometallurgy, 32(2), 143–159. https://doi.org/10.1016/0304-386X(93)90020-E
- Elsner, L. (1846). Beobachtungen iiber das Verhalten regdischer Metalle in einer wiissrigen Liisung yon Cyankalium. Journal Für Praktische Chemie, 37(Wiley Online Library), 441–446. https://doi.org/https://doi.org/10.1002/prac.18460370167
- Isaia, F., Aragoni, M. C., Arca, M., Caltagirone, C., Castellano, C., De Filippo, G., Garau, A., Lippolis, V., & Pivetta, T. (2017). Gold and palladium oxidation/complexation in water by a thioamide-iodine leaching system. Green Chemistryfile:///C:/Users/JOSE MORENO/Downloads/Fu2019.Pdf, 19(19), 4591–4599. https://doi.org/10.1039/c7gc01310h
- Janin Jr, L. (1888). Cyanide of potassium as a lixiviate agent for silver ores and mineral. Cyanide of Potassium as a Lixiviate Agent for Silver Ores and Mineral, 46(Eng. J), 548–549.
- Khaing, S. Y., Sugai, Y., & Sasaki, K. (2019). Gold Dissolution from Ore with Iodide-Oxidising Bacteria. Scientific Reports, 9(1), 1–11. https://doi.org/10.1038/s41598-019-41004-8
- Liang, C. J., & Li, J. Y. (2019). Recovery of gold in iodine-iodide system–a review. In Separation Science and Technology (Philadelphia) (Vol. 54, Issue 6, pp. 1055–1066). Taylor and Francis Inc. https://doi.org/10.1080/01496395.2018.1523931
- Martín-Sánchez, M., Martín-Sánchez, M. T., & Pinto, G. (2013). Reactivo de Lugol: Historia de su descubrimiento y aplicaciones didácticas. Educación Química, 24(1), 31–36. https://doi.org/10.1016/s0187-893x(13)73192-6
- Medina, D., & Anderson, C. G. (2020). A review of the cyanidation treatment of copper-gold ores and concentrates. Metals, 10(7), 1–11. https://doi.org/10.3390/met10070897
- Meng, Q., Li, G., Kang, H., Yan, X., Wang, H., & Xu, D. (2020). A study of the electrodeposition of gold process in iodine leaching solution. Metals, 10(1). https://doi.org/10.3390/met10010050
- Ribeiro, P. P. M., Santos, I. D. Dos, & Dutra, A. J. B. (2019). Copper and metals concentration from printed circuit boards using a zig-zag classifier. Journal of Materials Research and Technology, 8(1), 513–520. https://doi.org/10.1016/j.jmrt.2018.05.003
- Sousa, R., Regufe, M. J., Fiúza, A., Leite, M. M., & Futuro, A. (2021). A systematic review of sustainable gold extraction from raw ores using alternative leaching reagents. The Extractive Industries and Society, 101–118. https://doi.org/10.1016/J.EXIS.2021.101018
- Wilson, H. W. (1974). NOBLE METALS SOLVATION AGENTS-HY DROXYKETONES AND IODINE AND IODIDE (Patent No. 3,826,750). United States Patent Office. http://patentimages.storage.googleapis.com/pdfs/US3826750.pdf
a. Universidad Autónoma de Coahuila, Facultad de Metalurgia, Carretera 57, km 5, C. P.25710, Monclova, Coahuila, México.
b. Universidad Autónoma de Zacatecas, Unidad Académica de Ciencias de la Tierra, Avenida Universidad 108, Progreso, 98050 Zacatecas, Zacatecas.
Correo electrónico: josemorenocedillos@audec.edu.mx


















