Eliminación de Cromo Trivalente mediante Electrodeionización
Por: C. A. Vázquez Campa, Y. Armenta Acosta, J. C. Martínez Barrón, M. Caudillo González, J. C. Baltazar, G. Vázquez, L. G. Alvarado Montalvo*
Resumen
Una de las mayores economías del Estado de Guanajuato es la industria del cuero, en donde uno de los principales reactivos utilizados son sales de Cromo trivalente. De ahí que se generen soluciones de enjuague con alto contenido de ese ión, y ha de notarse que el tratamiento de dichos efluentes ha sido históricamente un reto, por lo que cada día se trata de generar nuevos sistemas que permitan tratamientos alternativos y que sean amigables con el medio ambiente. Cr (III) no es catalogado toxicológicamente dañino, sí puede actuar como una sustancia potencialmente tóxica. En este sentido, se ha aplicado un proceso de Electrodeionización en soluciones sintéticas de Cromo trivalente evaluando el desempeño de la tecnología, logrando alcanzar hasta un 96% de remoción de dicho ión.
Palabras Clave: Electrodeionización, Electrodiálisis, Cromo trivalente.
Introducción
Una de las más importantes economías en el estado de Guanajuato es la industria del cuero, en donde uno de los principales reactivos utilizados es la sal de cromo trivalente; de ahí que soluciones de enjuague sean generadas con alto contenido de dicho ion como para poder ser desechada directamente. Aunque en sentido estricto el Cr (III) no presenta toxicidad, su relación al Cromo hexavalente crea potencialidad de un impacto ambiental [1]. En este contexto, diversos procedimientos han sido implementados para el tratamiento de efluentes de este tipo, como la precipitación química, los procesos de adsorción y el intercambio iónico [2-4]. Sin embargo, lo anterior no resuelve lo relacionado a la disposición de los residuos generados; de ahí la importancia de diseñar tecnologías capaces de tener cero residuos y sistemas cíclicos que permitan la prevención de impactos ambientales. Unas de las tecnologías propuestas es la aplicación de procesos de membranas: Electrodiálisis y Electrodeionización [5-10], las cuales son capaces de concentrar las soluciones iónicas para un posterior tratamiento y al mismo tiempo, purificar parte del volumen total de la solución.
Metodología Experimental
Los estudios se realizaron a una concentración de 100 ppm de Cr (III) a una temperatura de 25°C. Las soluciones de Cr (III) fueron preparadas a partir de CrCl3 – 6H2O, (Baker Analyzed® 99.1% pureza) empleando agua destilada. Los análisis de Cromo se realizaron mediante Espectroscopía de Adsorción Atómica (Perkin Elmer AAnalyst 200).
Diseño y caracterización del sistema
Celda de Electrodiálisis
Se diseñó una celda de 40 cm2 de área efectiva, con un compartimento diluido y un compartimento concentrado. Los electrodos utilizados fueron acero inoxidable como cátodo y ánodo dimensionalmente estable, Ti/ RuO2. Los compartimentos diluido y concentrado tuvieron un espesor de 5 mm. Las membranas utilizadas fueron AMI-7001 y CMI-7000 de Membranes International Inc. Como solución electródica se utilizó una solución 0.1 M de Na2SO4. El volumen en diluido y concentrado fue de 250 mL, los cuales fueron recirculados en el sistema a un flujo de 20 mL min-1.
Determinación de corriente límite
La determinación de corriente límite fue llevada a cabo mediante un potenciostato-galvanostato, Princeton Applied Research, modelo VMP2- 220. Circulando la solución a un caudal de 20 mL min-1 y aplicando un barrido de potencial de 5 mV s-1 entre el OCP y 5 V.
Electrodeionización
La celda fue trabajada como proceso de Electrodiálisis, ED, y posteriormente, su compartimento diluido fue rellenado con resina catiónica Dowex 50wx8 (Sigma Aldrich®) aplicándosele el 80% de la corriente límite obtenida en la etapa anterior (ED). El caudal fue el mismo descrito en el diseño de la celda, al igual que el volumen de solución tratada planteado, 250 mL de diluido y concentrado respectivamente. Fue monitoreada la concentración a distintos tiempos hasta llegar a un total de 6 h.
Resultados y Discusión
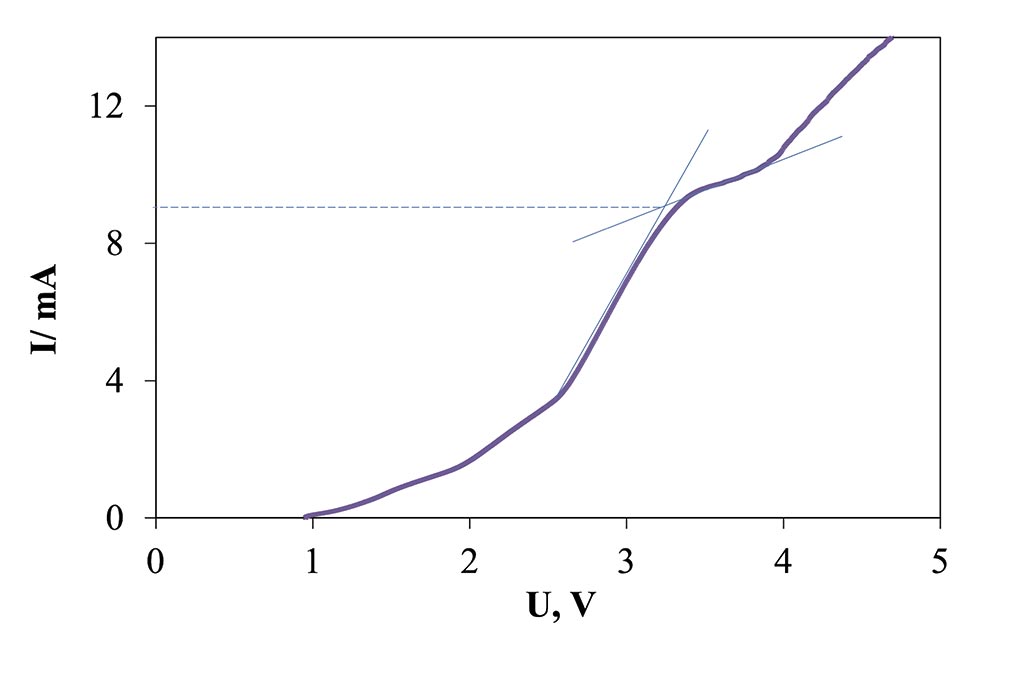
En la Figura 1 puede ser observada la voltametría líneal obtenida para la determinación de corriente límite. Como puede verse en dicho gráfico, a partir de 1 V se comienza a notar un aumento en la corriente, lo que es un indicador de la velocidad a la que los iones atraviesan las membranas; ello continua a un mismo gradiente de cambio hasta llegar a 2 V, donde después de este valor los cambios son más pronunciados, llegando así a ver un cambio hasta después de la aplicación de 3.4 V, pues el gradiente de corriente obtenida en el sistema decae drásticamente, significativo de que se ha superado el valor de corriente límite. Después de este punto la energía aplicada deja de ser utilizada solo en el transporte de iones, pues comienzan a realizarse a la par reacciones parásitas, como es la formación de H+ y OH– del agua en la interfase con la membrana. El punto de corriente límite a las condiciones descritas fue de 9 mA.
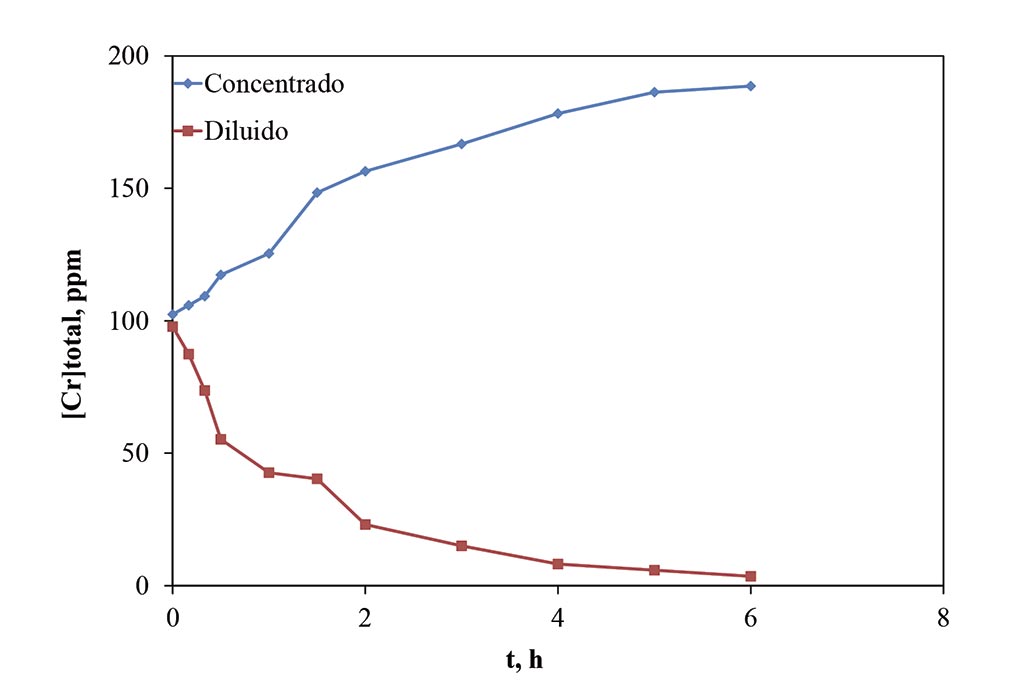
El resultado de la variación de concentración durante el proceso de Electrodeionización puede verse en la Figura 2, donde la primera media hora los cambios son más representativos, logrando llegar incluso a un 50% de disminución de la concentración del Cr (III), sin embargo, pasando dicho punto la velocidad de cambio en la concentración se ve disminuida, bajando alrededor de 30 ppm durante la siguientes 1.5 h, y de las últimas 20 ppm contenidas se remueven durante las siguientes 4 horas, llegando a una concentración final de 3.5 ppm. Es importante hacer notar que el proceso de electrodiálisis llevó hasta 11 horas para obtener una concentración de 7 ppm. El gasto de energía en el caso de ED fue de 2.6 KHW/m3, mientras que para EDI fue de 1.23 KWH/m3.
Si bien el proceso de Electrodeionización mostró reducir el tiempo en comparación con el proceso de Electrodiálisis, y el gasto energético fue menor a la mitad, el proceso sigue siendo perfectible. En este caso la limitante fue el lecho utilizado, pues si bien es un lecho catiónico y ofrece una ruta sólida para el movimiento de los iones de Cr (III), al no ofrecer una ruta aniónica, esto se vuelve una limitante para que el flujo de iones se vea incrementado a la par, bajo el principio de electroneutralidad.
Conclusiones
El proceso de Electrodeionización ofrece ventajas frente a un sistema de electrodiálisis convencional, y es una alternativa que puede irse implementado a escala piloto e industrial, sin embargo, debe continuar trabajándose en el lecho empacado, con la finalidad de ofrecer rutas de movimiento iónico que permitan al sistema no se vea limitado en cuanto a la velocidad de transporte de masa.
Agradecimientos
Los autores agradecen el apoyo otorgado por el PRODEP, el cual financió el proyecto de incorporación de nuevos PTC “Estudio de la remoción de Cr (III) de soluciones sintéticas mediante Electrodiálisis”; además, de igual forma se agradece el apoyo derivado de este financiamiento para la beca de licenciatura del estudiante Carlos Alfredo Vázquez Campa.
Referencias
- [1] M. Costa, C. Klein, Toxicity and carcinogenicity of chromium compounds in humans, Crit. Rev. Toxicol. 36 (2006) 155-163.
- [2] S. Rengaraj, K. H. Yeon, S. H. Moon, Removal of chromium from water and wastewater by ion exchange resins, Journal of Hazardous Materials, 87:1-3, (2001) 273-287.
- [3] G. Crini, N. Morin-Crini, N. Fatin-Rouge, S. Déon, P. Fievet. Arabian, Metal removal from aqueous media by polymer-assisted ultrafiltration with chitosan, J. of Chem. 10:2 (2017) S3826-S3839
- [4] K. Mohammed, O. Sahu, Recovery of chromium from tannery industrial waste water by membrane separation technology: health and engineering aspects, Scientific African, 4 (2019) e0096.
- [5] P. Baticle, C. Kiefer, N. Lakhchaf, O. Leclerc, M. Persin, J. Sarrazin, Treatment of nickel containing industrial effluents with a hybrid process comprising of polymer complexation-ultrafiltration-electrolysis, Sep. and Purif. Technol. 18:3 (2000) 195-207.
- [6] W. Liu, Y. Yu, Removal of recalcitrant trivalent chromium complexes from industrial wastewater under strict discharge standards, Environm.Technol. and Innov.23 (2021) 101644.
- [7] A. Mahmoud, A. F. A. Hoadley, An evaluation of a hybrid ion exchange electrodialysis process in the recovery of heavy metals from simulated dilute industrial water, Water Research, 46:10, (2012) 3364-3376.
- [8] L. Alvarado, A. Chen, Electrodeionization: Principles, Strategies and Applications Electrochim. Acta, 132 (2014) 583-597.
- [9] S. A. Amshawee, M. Y. B, M. Yunus, A. A. M. Azoddein, D. G. Hassel, I. H. Dakhil, H. A. Hasan, Electrodialysis desalination for water and wastewater: a review, Chem. Eng. J., 380 (2020)
- [10] L. Alvarado, I. Rodríguez, A. Chen, Integration of ion exchange and electrodeionization as a new approach for the continuous treatment of hexavalent chromium wastewater, Sep. and Purific. Technol. 105 (2013) 55-62.
División de Ingenierías, Universidad de Guanajuato, Campus Guanajuato.

















