Ensaye al fuego de muestras tipos óxidos de un proceso gravimétrico. Una evaluación de las mezclas fundentes utilizadas
Por: Alan Salazar Garibay 1, Ma. de Jesus Soria Aguilar 1, Francisco Raúl Carrillo Pedroza 1
Resumen
Este trabajo versa sobre el estudio del método de ensaye al fuego como la técnica analítica de oro y plata más utilizada en la industria minero-metalúrgica. Como caso de estudio, se analizaron por este método muestras obtenidas de un proceso de concentración gravimétrico (alimentación, concentrado y colas). Los datos de los ensayes fueron analizados mediante gráficos de correlación, a fin de encontrar y explicar los resultados obtenidos. De estos, se determinó que, conociendo el análisis elemental y lo que se añade con la mezcla de reactivos en el ensaye al fuego, es posible obtener un análisis muy preciso, en muestras de alta, media y baja ley.
Palabras clave: Ensaye al fuego, copelación, oro, plata.
Abstract
This work is about the fire assay method, the most used gold and silver analytical technique in the mining-metallurgical industry. As a case study, samples obtained from a gravimetric concentration process (feed, concentrate and tails) were analyzed by this method. The data of the tests were analyzed using correlation graphs, to find and explain the results obtained. From these, it was determined that, knowing the elemental analysis and what is being added with the reagent mixture in the fire test, it is possible to obtain a very precise analysis in high, medium and low grade samples.
Keywords: fire assay, cupellation, gold, silver.
Antecedentes
El ensayo al fuego es definido como una rama del análisis químico cuantitativo, el cual es aplicado en la determinación del contenido de metales preciosos, particularmente oro y plata, en muestras geológicas y minerales, así como en productos y subproductos de procesos metalúrgicos extractivos (Juvonen y Kontas, 1999; Magalhaes et al., 2011). El método es una técnica pirometalúrgica (basada en el uso del fuego o calor) en el cual se separan, el metal o los metales que serán determinados, de las impurezas y de la ganga presente en la muestra (Everett, 2005; Compernolle et al., 2011; Cerceau et al., 2016). Cabe señalar que el método continúa siendo el más utilizado para la determinación del contenido de oro y metales preciosos, aunque la eficiencia y desempeño del mismo es altamente dependiente de la experiencia del laboratorio y/o del técnico que lo realiza (Juvonen y Kontas, 1999; Wang, 2016).
El método de ensaye al fuego no ha variado mucho a lo largo de los últimos 100 año (Bugbee, 1922; McGuire, 1998; Everett, 2005; Ni et al., 2019; Santos-Munguia et al, 2019). Quizás haya algunas variantes en cuanto a los equipos utilizados, mayor control y precisión en las variables, así como la validación o soporte con otras técnicas analíticas (Rodriguez-Rodriguez et al., 2014; Wang et al., 2016; Sokolov et al, 2018). Pero, en lo general sigue los mismos pasos o procedimientos que a continuación se describen de manera breve (McGuire, 1998; Attala, 2012):
Preparación de la muestra
El muestreo puede ser definido como la operación, mediante la cual se extrae una porción del todo de una muestra de material obtenido en una porción grande, reduciéndola a una cantidad, con la mínima alteración de cualquiera del total de sus características. La preparación de una buena muestra para ensayo al fuego deberá cubrir todos los pasos siguientes: Cuarteo, secado, quebrado, pulverizado, mezclado y homogeneizado (Guresin et al., 2012).
Mezcla de fundentes
A fin de determinar el fundente ideal para cualquier tipo de muestra se requieren conocimientos sobre los diferentes tipos de minerales y conocimientos elementales de los procesos pirometalúrgicos. Los principales reactivos utilizados en el proceso de ensayo son los siguientes(McGuire, 1998):
Litargirio. Es un material fácilmente fundible, considerado como fundente básico, el cual también actúa como agente desulfurante y oxidante. Funde a la temperatura de 883°C y cuando es reducido actúa como proveedor del plomo metálico, necesario para colectar los metales nobles. El Litargirio posee una gran afinidad por la sílice y cuando el mineral no la contiene en una cantidad apropiada, el PbO atacará las paredes del crisol rompiéndolo o eventualmente agujerándolo
Carbonato de Sodio. Es un poderoso fundente del tipo básico, el cual funde a la temperatura de 852°C, es un invariable constituyente de una mezcla de fundente o flujo para minerales del tipo silicosos. En la presencia de la sílica el carbonato de sodio forma silicato de sodio, con la respectiva evolución de dióxido de carbono. Estos silicatos reaccionan al mismo tiempo con otros tipos de minerales oxidados básicos formando silicatos complejos. En el ensaye a fuego, el carbonato de sodio en conjunto con el óxido de plomo y el bórax contribuyen a la formación de un medio en el cual se forman complejos metálicos boratados y silicatos, los cuales exponen a los metales nobles a la acción extractante del plomo. Así mismo, es considerado como un agente desulfurante y oxidante.
Bórax. Es un material extremadamente viscoso cuando se funde, pero al fuego rojo se torna fluido y de un carácter fuertemente ácido, disolviendo y fundiendo prácticamente todos los óxidos metálicos ya sean básicos o ácidos. En adición, el hecho de que funde a la temperatura de 742 ° C, facilita la formación de las grasas para colectar impurezas de la muestra, aparte de ayudar a bajar la temperatura de fusión de las mismas.
Silica. Es un material que funde a la temperatura de 1750 ° C y es uno de los materiales fundentes de carácter ácido más fuertes, utilizados en el proceso de ensaye a fuego; se combina con los minerales oxidados para formar grasas y compuestos silicosos, es el fundamento o base de todas las grasas formadas. Así mismo, es utilizado con la finalidad de proveer un material ácido que reaccione con los materiales básicos que constituyen el mineral. Protege el crisol de la acción corrosiva del Litargirio. Si es usado en exceso puede ocasionar pérdidas de metales nobles y en algunas ocasiones formamos compuestos como los del tipo mate.
Harina. Este material (harina de trigo) se usa como agente reductor, sin embargo, puede ser sustituido por otros materiales. El material que contiene actúa reduciendo una parte del Litargirio a plomo metálico quien colectará los metales preciosos.
Nitrato de Potasio. Comúnmente conocido como sal nitro, es utilizado principalmente para efectuar la oxidación de los sulfuros presentes en los diferentes tipos de minerales. El empleo en exceso de este material afecta al proceso de fundición de la muestra ya que provoca que el mineral hierva en el crisol, haya derrames y por lo tanto tengamos pérdidas de material fundido.
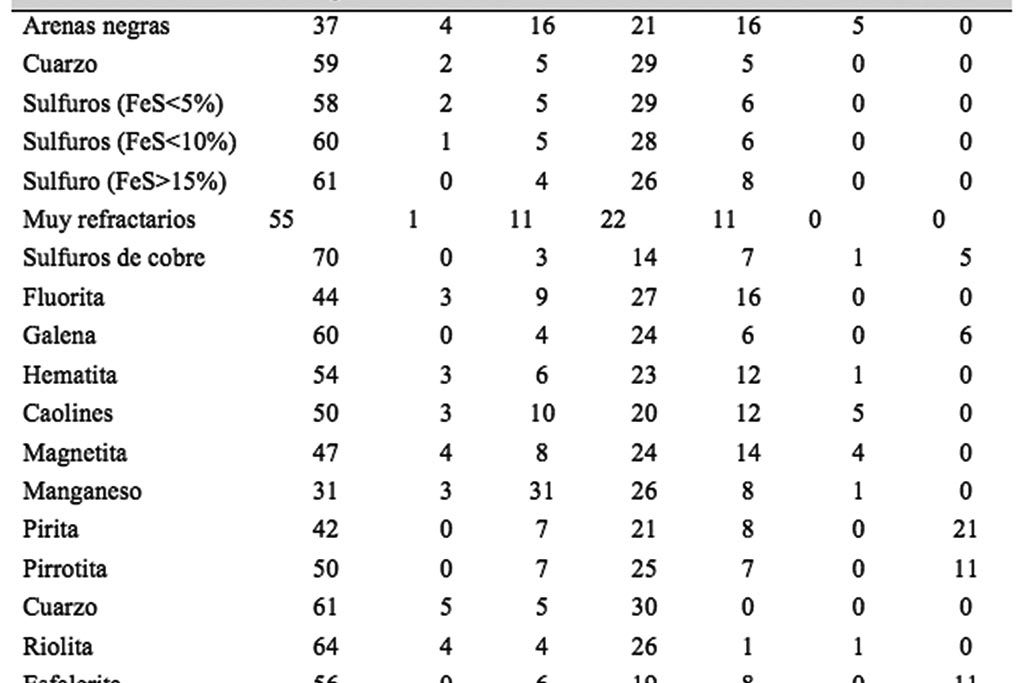
para diferentes tipos de minerales.
Además de la harina, otros agentes reductores pueden ser agregadas a la carga para reducir el litargirio a plomo metálico. Entre los de mayor utilización están el carbón de leña, azufre, hierro metálico, etc.
Y los agentes oxidantes, que tienen por objeto eliminar As, Sb, Fe y Cu, y por otro lado disminuir el poder reductor de algunas menas, como aquellas que contienen azufre elemental y los sulfuros (principalmente pirita), cuyo poder reductor también dependerá del carbonato de sodio agregado a la mezcla fundente. También hay que considerar que la presencia de minerales oxidados, como hematita, magnetita o pirolusita, le dan poder oxidante, por lo que hay que tomarlos en cuenta al momento de calcular la cantidad de reductor a utilizar.
Debido a lo anterior, se han desarrollado diferentes proporciones de los agentes oxidantes y reductores, dependiendo del tipo de mineral que contiene los metales nobles, tal como se observa en la Tabla I.
Fusión
La muestra se lleva al estado de fusión por medio del agregado de fundentes a temperaturas que oscilan entre 600 °C y 1100 °C, en lo posible se trata de no superar los 1200ºC, ya que alcanzar temperaturas superiores significaría hornos y refractarios especiales (altos costos de análisis). La fusión tiene por objeto liberar los metales nobles de su ganga y facilitar la colección de estos en una matriz de Plomo. Una vez fundida la carga, esta se separa en dos fases principales, la fase escoria y la fase metálica, llamada régulo de plomo, que contiene los metales de interés. Es de importancia en la fundición en crisoles la existencia en exceso de PbO ya que parte de él, se usa para el régulo y parte para formar la escoria. El tamaño del régulo de Pbº, depende no sólo del efecto reductor y/u oxidante de la carga y de los agentes agregados, sino también del carácter de los componentes de la muestra (Compernolle, y al., 2011; Bugbee, 1992).
La principal reacción que ocurre durante la fusión es la reducción del litargirio (PbO) con harina:
12PbO + C6H10O5 → 12Pb + 6CO2 + 5H2O
Como se ha mencionado, la fusión tiene por objeto fundir la carga de mineral, para liberar los metales nobles de su ganga, formando dos fases principales, una metálica, compuesta de plomo líquido, cuyo objetivo es la colección de estos metales (que no se oxidan), y la fase escoria, la cual contendrá los elementos presentes en el mineral, que se oxidan durante la fusión.
La elección del Pb° como metal portador de los metales en el análisis por vía seca, se debe a tres factores principales: Su bajo costo, su ubicación privilegiada en la serie electromotriz y porque es fácil separar los metales nobles de las aleaciones de Pb.
Copelación
Este proceso tiene como objetivo liberar los metales nobles del régulo de plomo con la eliminación de Pb como PbO mediante la absorción del óxido fundido en un recipiente llamado “copela”, éste es un tronco de cono invertido fabricado de ceniza de hueso, cemento, magnesia o una mezcla de los dos primeros. En el proceso de copelación se pueden distinguir 6 etapas: 1) Precalentamiento de la copela; 2) Carga del régulo; 3) Apertura del régulo; 4) Oxidación del Pb; 5) Final de la copelación; 6) Remoción de la copela de la mufla.
La copelación, es un proceso de oxidación que se realiza a 900ºC y donde el plomo (punto de fusión de 329ºC) es en gran parte absorbido por la copela en forma de óxido, quedando sobre la copela un botón metálico de oro y plata (que se le conoce como metal doré). La reacción es la siguiente:
Pb(l) + ½ O2 → PbO
Al estar oxidándose el plomo líquido por efecto de la reacción anterior, los metales nobles (oro y plata, principalmente) se van concentrando en la aleación, hasta llegar a solidificar, tal como se muestra en la Figura 1. Estos diagramas muestran porque el plomo es usado como colector de los metales nobles, ya que se forman aleaciones de bajo punto fusión dentro del plomo líquido. Y, en el caso de la copelación, al aumentar su concentración en el líquido, por efecto de la oxidación del plomo y su adsorción en la copela, se solidifican formando el botón de dore.
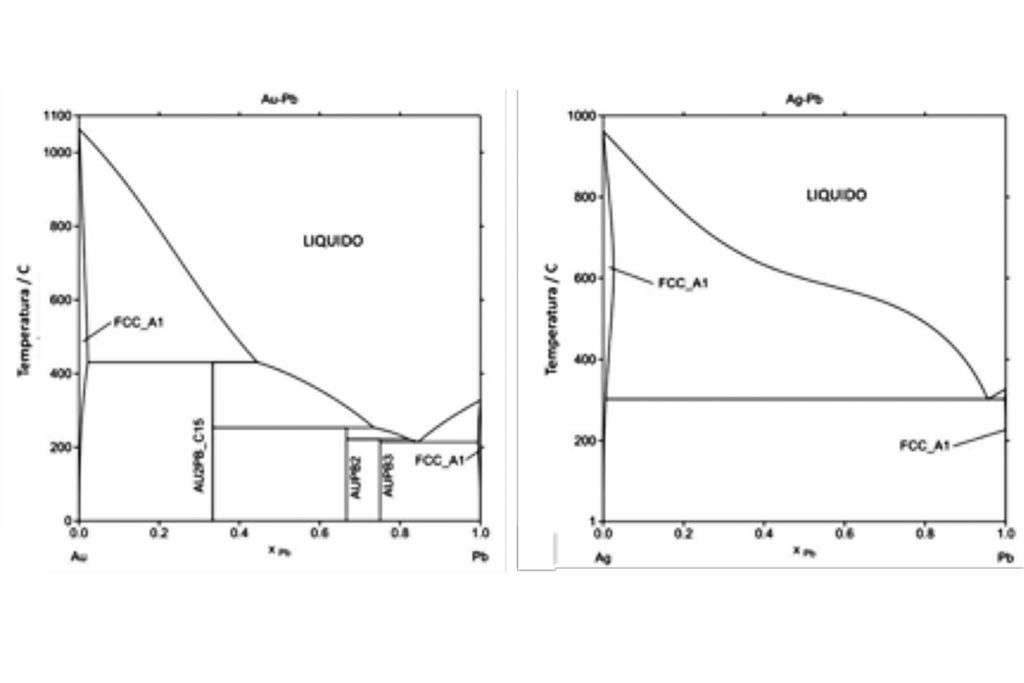
Partición, apartado o separación de la plata del oro
La perla se calienta en una solución de ácido nítrico para disolver la plata, dejando el oro sin disolver para que se lave, se seque y se pese. El apartado, el cual es un proceso químico para separar el oro de la plata utilizando ácido nítrico con densidad de 1.2 y temperatura de 80ºC para disolver la plata. La reacción química es:
Ag + HNO3 = AgNO3 + H2
En esta etapa es importante considerar la proporción plata – oro. Mientras mayor sea la proporción de plata en el doré, más rápido será el ataque, pero en altas proporciones (mayores de plata – oro de 6 a 1) causa el desmenuzamiento del doré. Cuando el contenido de plata es 2 veces o menor al del oro, no se ataca el doré, aún en ácido concentrado. Por lo tanto, una proporción adecuada de Ag a Au es de 4 a 1 ó 5 a 1 (aproximadamente un 20% de oro), la cual se debe asegurar desde la fusión o en la copelación, adicionando previamente plata.
Pesaje
Conociendo el peso original del mineral, el peso de la perla dorada y el peso del oro después del lavado y secado, la concentración de oro y plata del mineral se calcula por diferencia, mediante la siguiente formula:
Ley oro, g/ton = [Peso del oro (g)] x 1000000
Peso de la muestra (g)
Ley plata, g/ton = [Peso del doré (g) – peso del oro (g)] x 1000000
Peso de la muestra (g)
El presente trabajo tiene como objetivos, conociendo los fundamentos y las variables del método que inciden en la determinación de oro, encontrar la mejor mezcla para el análisis de muestras provenientes de un proceso gravimétrico de concentración de dicho metal, así como evaluar su desempeño respecto a muestras de alta, media y baja ley, y con ello, asegurar la confiabilidad de los ensayes obtenidos por este método de ensaye al fuego.
Metodología experimental
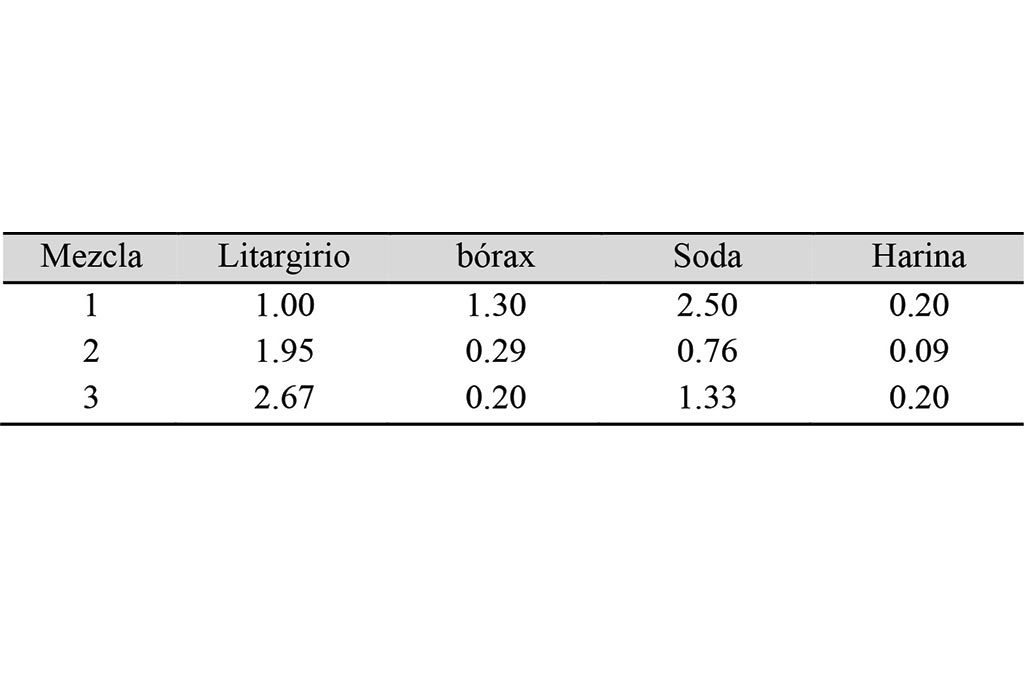
Las muestras provenientes de la concentración gravimétrica fueron pulverizadas y tamizadas a un tamaño menor a 150 micras. Cada muestra para ensayar fue pesada y colocada en un recipiente al cual se le añadieron los reactivos para el ensaye al fuego. En el presente estudio, se utilizaron 4 diferentes mezclas, como se muestran en la Tabla II, la cual indica la relación en peso de cada reactivo con respecto al peso del mineral. Por ejemplo, la mezcla 1 se prepara mezclando, por cada parte de mineral, una parte de litargirio, 1.3 de bórax, 2.5 partes de soda (carbonato de sodio) y 0.2 partes de harina.
Estas mezclas fueron escogidas en función de las muestras minerales consideradas en este trabajo, las cuales, de acuerdo con una caracterización previa, contienen principalmente hematita y cuarzo, y minoritariamente óxidos y sulfuros de hierro y zinc. Los reactivos se mezclaron con la muestra de mineral, se homogenizó y se agregó a un crisol de barro. Los crisoles se depositaron dentro de un horno eléctrico a 950°C durante 30 min. Una vez que el tiempo ha transcurrido se procedió a verter el contenido del crisol en la lingotera, donde se solidifica, se retira la escoria y se libera el régulo de plomo que contiene los metales de interés (Au y Ag); a los régulos de plomo se les dio forma de cubos por medio de un martillo para su mejor manipulación al momento de pasar a la etapa de copelación. Para realizar la etapa de copelación se utilizan copelas de ceniza de hueso, las cuales se precalientan a una temperatura de 850°C para después depositar el régulo de plomo con la finalidad de eliminar el Pb. Se retira la copela del horno, se extrae y se lamina el doré obtenido.
El botón laminado se coloca en un crisol de porcelana sobre una plancha de calentamiento y se adiciona ácido nítrico al 15% para disolver la plata. El oro se lava con agua destilada y se seca a temperatura ambiente durante 20 minutos. Finalmente, el oro se pesa y se hace el cálculo correspondiente para determinar los gramos por tonelada.
Resultados y discusión
Se analizaron varias muestras representativas obtenidas de un proceso de concentración gravimétrico. De este proceso se evaluaron por separado los ensayes de la alimentación y colas (concentración de oro menor a 20 g/ton, llamado de baja ley), los de los medios (llamado también segundo concentrado, con leyes entre los 20 y 100 g/ton) y los del primer concentrado (o de alta ley, mayor a 300 g/ton).
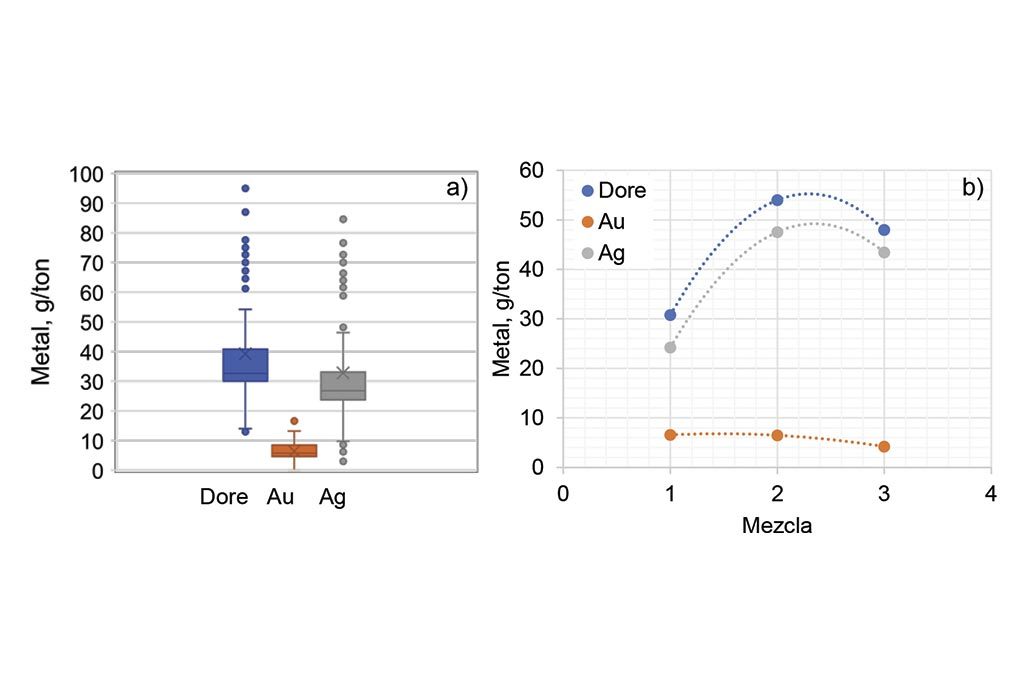
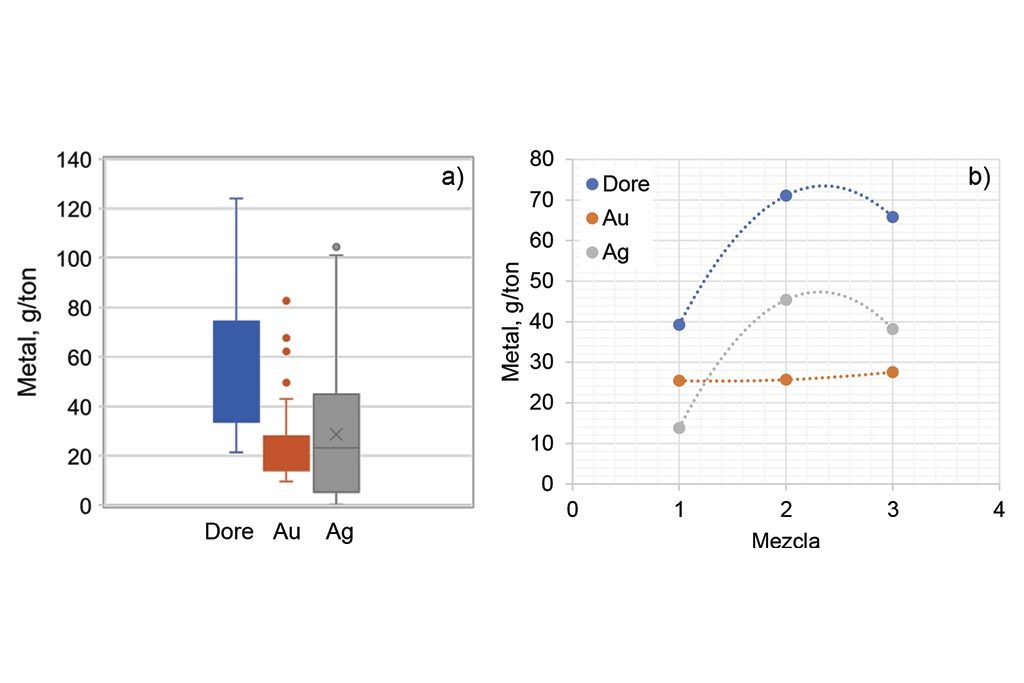
La Figura 2a) muestra un gráfico de cajas que permite observar el rango de concentración de los metales en las muestras ensayadas (130 muestras). Como se sabe, la caja representa el 50% de las muestras dentro de la cual se representa la media (asterisco) y la mediana (línea horizontal); Por debajo y arriba de la caja salen los llamados bigotes, dentro de los cuales se distribuye hasta el 50 % de los datos restantes (en una distribución normal); los puntos fuera de los bigotes representan datos atípicos o que están fuera de la distribución; generalmente la distancia de los bigotes es de 1 a 1.5 veces la altura de la caja hacia ambos lados. Los datos fuera de esta “longitud” son los llamados atípicos, y son considerados dentro de la dispersión y/o desviación estándar de los datos.
Por lo tanto, la figura muestra que, de las 130 muestras, alrededor del 95% tienen la siguiente composición: La concentración de dore fluctúa entre 12 y 55 g/ton, la plata de 10 a 45 g/ton, y el oro entre 1 y 14 g/ton. Se observa que el doré y la plata tienen un mismo comportamiento de caja, incluyendo la dispersión o los datos atípicos, en tanto que el oro tiene una dispersión muy baja. Cabe reiterar que aquí están concentrados todos los ensayes de muestras de baja ley, independientemente de la mezcla utilizada. Por lo tanto, la figura indica que, para muestras de baja ley, el análisis de oro tiene poca variabilidad, mostrando una caja de muy baja altura, y sólo un dato atípico (es decir, prácticamente sin dispersión); independientemente de la mezcla utilizada. Es importante mencionar que estas muestras son principalmente colas del proceso gravimétrico, y cabeza de alimentación. En ambos casos, su composición mineralógica es muy similar, con alta concentración de cuarzo, caliza y feldespatos (minerales de menor densidad).
Lo anterior se corrobora al graficar el contenido de los metales con respecto a las mezclas usadas, como se puede observar en la Figura 2b). En el oro, el cambio o tendencia es mínima para las tres mezclas, en tanto que, para la plata, si se ve afectada. En este punto cabe resaltar que, dado que son muestras provenientes de un solo tipo de yacimiento, y tratadas en un mismo proceso (a diferencia de la serie anterior que eran muestras de yacimientos diferentes y de diferentes procesos), la diferencia o comportamiento de la plata está relacionada directamente con la cantidad de litargirio. Esto se debe a que el litargirio contiene una cantidad de plata (proporcionada por el proveedor) que es añadida para dar la mencionada relación Ag:Au. Por eso, la plata (y el dore) aumentan, al aumentar la cantidad de litargirio en la mezcla.
La Figura 3a) muestra el gráfico de cajas para las muestras obtenidas del proceso como producto medio (llamado también segundo concentrado o secundario), en donde se observa como se distribuyen los metales dentro de las muestras ensayadas (50 muestras). Dichas muestras están constituidas de ambas fases principales del yacimiento (óxidos de hierro y cuarzo), con bajo feldespatos.
La gráfica de cajas muestra que la plata y el doré tienen el mismo tipo de comportamiento en cuanto a que son cajas con un sesgo hacia valores altos, en tanto que el oro tiene mayor algunos datos atípicos. Este comportamiento es indicativo de las fluctuaciones del proceso. Aquí cabe mencionar que la mesa gravimétrica trabaja en función del control de la densidad y flujo volumétrico de alimentación de la pulpa; Ambos parámetros pueden ser manipulados según se vaya observando el comportamiento de las líneas de separación en las mesas. En este sentido, cuando se cambia de lote de alimentación, se ajustan dichos parámetros durante el proceso. Como resultado, el efecto se observa en las leyes obtenidas, principalmente en estos medios o concentrado secundario, ya que es el intermedio entre la separación de las colas y el concentrado principal. Es decir, que puede diluirse (bajar su ley) o concentrarse (aumentar la ley) en oro. No así la plata, la cual, como se ha mencionado, está distribuida en las fases pesadas (óxidos de hierro) y las ligeras (cuarzo). El sesgo positivo (hacia arriba) es indicativo, como se ha mencionado, de aquellas muestras analizadas con mezclas de mayor contenido de litargirio (que contiene plata).
En la Figura 3b) se puede observar el comportamiento de estas mismas muestras (medios) en función de las mezclas. Al igual que en las muestras de colas, la concentración de oro permanece prácticamente igual, sin mucha variabilidad, con respecto a la mezcla, por lo que se puede deducir que el tipo de mezcla y, en particular, la cantidad de litargirio no tiene efecto sobre el análisis de oro, para muestras de baja y media ley. En el caso de la plata, nuevamente se repite el comportamiento de mayor concentración de plata en las mezclas que usan mayor litargirio. Es interesante destacar que, de acuerdo con la Tabla I, la mezcla 2 tiene 1.95 veces más litargirio que la 1, y la 3 es a su vez 2.67 veces mayor que la 1 (1.3 más que la 2). Sin embargo, en la mezcla 3 hay una disminución en el contenido de plata. En la práctica del ensaye al fuego, el usar más cantidad de litargirio por unidad de mineral produce un régulo (botón de plomo) más grande, el cual, al ser copelado, debe considerarse su volumen (en relación con la copela) para lograr una buena oxidación y adsorción en la misma. Sin embargo, dado que contiene más plata, mayor es la probabilidad de que la plata se oxide también. Esto explicaría la pérdida de plata en la mezcla 3.
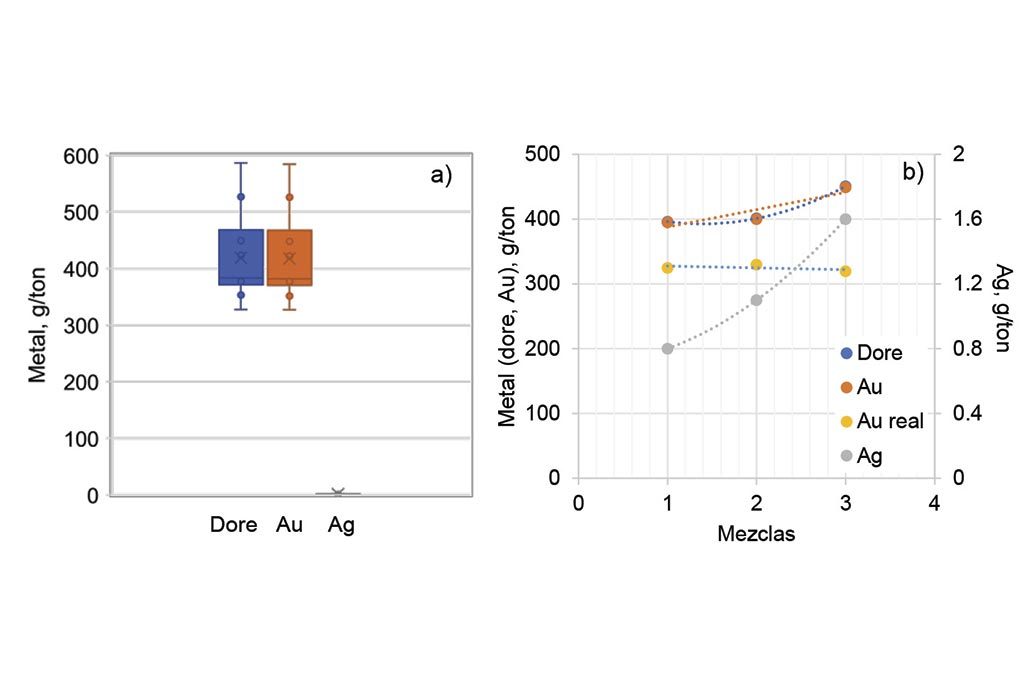
Finalmente, con respecto los concentrados, la Figura 4a) muestra los contenidos de metales nobles de las muestras ensayadas (11 muestras) en un gráfico de cajas, que indica el rango en el cual están dichos valores. Se observa que el doré esta ligeramente superior al contenido de oro, y que la plata prácticamente no existe. Esto coincide con que el oro es concentrado junto con lo más pesado, que son los óxidos de hierro, y que la plata se va con aquellos óxidos de hierro menos pesados (a los intermedios) y a las colas.
Analizando los resultados en función de las mezclas (Figura 4b)), se observa nuevamente que la plata está en una concentración mínima (menos de 2 g/ton), y que sigue la tendencia de ser más alta su concentración en las mezclas con más litargirio. Se observa que el doré y el oro muestran casi la misma concentración, siendo lógico por la manera de calcular el oro y la plata (peso del doré antes del lavado ácido y después de dicho lavado). Sin embargo, el oro muestra una tendencia creciente con las mezclas, tendencia que es significativa dada la variabilidad en concentración, de 53 g/ton de diferencia entre el menor y mayor valor, y el valor económico que representa y, por lo tanto, la necesidad de tener certidumbre en la medida. Y, consecuentemente, en la mezcla que debe utilizarse para tal ensayo.
Como se había mencionado, cuando se tienen altas concentraciones de oro y la relación plata-oro es menor de 2 (minerales con baja ley de plata), es conveniente poner plata en cantidad suficiente para alcanzar una buena proporción (entre 4 y 5). Si no es así, la plata es difícil de disolver y separar del doré, por lo que el peso antes y después del lavado del doré es casi el mismo, como lo es en el presente caso. Por lo tanto, hay una sobrevaluación del oro.
Por ello, se realizó un balance de masa, conociendo que el litargirio contiene una cantidad determinada de plata (29 g/ton). Dicha plata se le resta a la concentración de oro, de manera proporcionada conociendo la cantidad de litargirio usada en cada mezcla, para obtener el peso o concentración real del oro en las muestras. En la figura se muestra el resultado para oro real (Au real), observándose que, con ello, el oro obtenido es prácticamente el mismo, independientemente de la mezcla usada, con una variación de 10 g/ton, es decir, bajando la variabilidad en 5 veces.
Conclusiones
A partir de los resultados obtenidos y analizados en el presente trabajo, se pueden mencionar las siguientes conclusiones:
- Existen diferentes formulaciones de mezclas para el ensaye al fuego, las cuales se han establecido en función de las especies mineralógicas predominantes en una muestra. El conocimiento de la correlación entre minerales que actúan como oxidantes o reductores, con respecto a la cantidad de reactivos que componen las mezclas, y de las reacciones de oxidación, reducción y formación de fases, es crucial para validar si un ensaye está dando el análisis correcto.
- Aun para un mismo tipo de muestra, pero con diferente proporción de sus especies mineralógicas, se pueden usar varias mezclas que aplican a esas especies, sin que se afecte los resultados del ensaye al oro, y conociendo o teniendo en cuenta la proporción plata-oro adecuada.
- Finalmente, se comprueba que, con un conocimiento puntual del método de ensaye al fuego (en todas sus etapas: fusión, copelación y partición o apartado) y del efecto que tiene la plata, este método es una técnica analítica para la determinación de oro muy precisa, para cualquier tipo de muestra (baja, mediana y alta ley).
Referencias
- Attala, L. I., 2012. Arte de ensayar los minerales para determinar los metales que contienen y en qué proporción. Docimasia: Capacitación Personal de Laboratorio de OROPLATA SA.
- Bugbee, E. E., 1922. A Textbook of Fire Assaying. New York. John Wiley & Song, Inc.
- Cerceau, C., Carvalho, C., Silveira Rabelo, A., Gouvea dos Santos, C., Dias Goncalves, S., Vieira Varejao, E., 2016. Recovering lead from cupel waste generated in gold analysis by Pb-Fire assay. Journal of Environmental Management, 183, 771-776.
- Compernolle, S., Pisonero, J., Bordel, N., Wambeke, D., De Raedt, I., Kimpe, K., Vanhaecke, F., 2011. Evaluation of pulsed radiofrequency golw discharge time-of-flight mass sepectrometry for precious metal determination in lead fire assay buttons. Analytica Chimica Acta, 701, 129-133.
- Everett, G., 2005. Fire assay. Encyclopedia of Analytical Science (second Edition), pp. 17-24.
- Guresin, N., Lorenzen, L., Dominy, S.C., Muller, H., Cooper, A., 2012. Importance of effective sampling and test protocols for process plant design. Sampling Conference, Perth, Western Australia, Aug., 21–22, 2012, pp. 95–107.
- Juvonen, R., Kontas, E., 1999. Comparison of three analytical methods in the determination of gold in six Finnish gold ores, including a study on samples preparation and sampling. Journal of Geochemical Exploration, 65, 219-229.
- Magalhaes, F., Carvalho, C., Netto Carvalho, E., Yoshida, M., Govea dos-Santos, C., 2012. Rendering wastes obtained from gold analysis by the lead-fusion fire-assay method non-hazardous. Journal of Environmental Management, 110, 110-115.
- Marion, C., Langlois, R., Kökkilic, O., Zhou, M., Williams, H., Awais, M., Rowson, N., 2019. A design of experiments investigation into the processing of fine low specific gravity minerals using a laboratory Knelson Concentrator. Minerals Engineering, 135, 139-155.
- McGuire, M.A., 1989, “Trial by Fire, A Fire Assay Short Course,” Newmont Metallurgical Services, June 2, 1989.
- Ni, W., Mao, X., Zhang, H., Liu, L., Gao, X., Xiao, F., 2019. Lead fire assay preconcentration and high resolution continuum source graphite furnace atomic absorption spectrometry for the determination of ultra-trace amounts of Au, Ir, Pd, Pt and Rh in rocks and minerals. . Spectrochimica Acta Part B, 158, 105643.
- Rodríguez-Rodríguez, Y., Rodríguez, I., Prieto García, J., Basilio De la Torre, J., Acosta Martínez, F., 2014. Validación del método ensayo al fuego combinado con espectrofotometría de absorción atómica (EF-EAA). Anuario de la Sociedad Cubana de Geología, 2, 143-149.
- Santos-Mungía, P., Nava-Alonso, F., Rodríguez-Chávez, V., Alonso-González, O., 2019. Hidden gold in fire assay of gold telluride ores. Minerals Engineering, , 105844.
- Sokolov, A., Bourmistenko, Y., Gostilo, V., Titov, V., 2018. Industrial gamma-activation assay system for gold ore analysis. Minerals Engineering, 116, 179-181.
- Wang, Y., Baker, L., Brindle, I., 2016. Determination of gold and silver in geological samples by focused infrared digestion: A re-investigation of aqua regia digestion. Talanta, 148, 419-426.
1 Universidad Autónoma de Coahuila, Facultad de Metalurgia, Carr. 57, km 5, C. P. 25710, Monclova, Coahuila, México.
Correspondencia para autor: raul.carrillo@uadec.edu.mx


















